Los astrocitos constituyen una cuarta parte del cerebro, pero los investigadores justo ahora se están dando cuenta de su verdadero valor.
Bajo un microscopio óptico, las células cerebrales llamadas astrocitos tienen forma de estrella. Crédito: Nancy Kedersha/Science Photo Library
Durante décadas, los neurocientíficos se centraron casi exclusivamente en la mitad de las células del cerebro. Pensaban que las neuronas eran las protagonistas principales, y que todo lo demás estaba compuesto por sistemas de apoyo poco interesantes .
En la década de 2010, la investigadora de la memoria Inbal Goshen comenzó a cuestionar esa suposición. Se inspiró en herramientas moleculares innovadoras que le permitirían investigar las contribuciones de otro grupo de células más misterioso, los astrocitos. Lo que descubrió sobre su papel en el aprendizaje y la memoria la entusiasmó aún más.
Al principio, se sentía como una extraña, sobre todo en las conferencias. Se imaginaba a sus colegas pensando: «Ah, ese es el bicho raro que trabaja con astrocitos», dice Goshen, cuyo laboratorio está en la Universidad Hebrea de Jerusalén. Mucha gente se mostró escéptica, comenta.
Pero ya no. Una avalancha de estudios de laboratorio en diversos subcampos revela la importancia de estas células en la configuración de nuestro comportamiento, estado de ánimo y memoria . Consideradas durante mucho tiempo como células de soporte, los astrocitos se están convirtiendo en actores clave en la salud y la enfermedad.
“Las neuronas y los circuitos neuronales son las principales unidades de computación del cerebro , pero ahora está claro en qué medida los astrocitos influyen en esa computación”, afirma la neurobióloga Nicola Allen, del Instituto Salk de Estudios Biológicos en La Jolla, California, quien ha dedicado su carrera a la investigación de los astrocitos y otras células no neuronales, llamadas colectivamente células gliales. “Las reuniones gliales tienen ahora una sobreabundancia constante de participantes”.
Fuera de las sombras
Ya en el siglo XIX, los científicos podían ver con sus microscopios simples que los cerebros de los mamíferos incluían dos tipos principales de células : neuronas y glía, en cantidades aproximadamente iguales.
Las tecnologías del siglo XX generaron gran parte del entusiasmo en torno a las neuronas. Los investigadores que estudiaban la actividad eléctrica de las células demostraron cómo crean las complejas redes que subyacen a todas las funciones cerebrales.
Cuando las neuronas se activan, las señales eléctricas se extienden a lo largo de su longitud a una velocidad vertiginosa, provocando que sus sinapsis liberen neurotransmisores químicos. Algunos de estos, como el glutamato , excitan a las neuronas vecinas, mientras que otros, como el GABA (ácido γ-aminobutírico), las inhiben. El desarrollo de una técnica llamada fijación de parche en las décadas de 1970 y 1980, en la que se insertan electrodos en células individuales para medir el flujo de iones a través de las membranas, permitió a los investigadores estudiar esta neurotransmisión con un detalle sin precedentes.
En cambio, las células gliales parecían ser eléctricamente silenciosas y la mayoría de los investigadores las descartaban por su apatía. Algunas células gliales, llamadas oligodendrocitos, recubren y aíslan las neuronas. Otras, la microglía, proporcionan el sistema inmunitario del cerebro . Las múltiples funciones de los astrocitos resultaron más difíciles de comprender.
Aunque pocos neurocientíficos se centraron en los astrocitos hasta bien entrada la década del 2000, algunos descubrimientos fundamentales se hicieron antes de eso 1 . Bajo el microscopio óptico, los astrocitos tienen forma de estrella, extendiéndose entre las neuronas y los diminutos vasos sanguíneos del cerebro. Indican a los vasos sanguíneos que aumenten o disminuyan su flujo según la actividad neuronal y extraen oxígeno y otras moléculas vitales de la sangre para enviarlas a las neuronas. Limpian los productos de desecho alrededor de las sinapsis y regulan los niveles de iones allí. Extraen glutamato alrededor de las neuronas para evitar que los circuitos excitatorios se sobrecarguen, descomponen el neurotransmisor y luego devuelven sus componentes básicos a las neuronas.
Los astrocitos adquirieron mayor interés cuando fue posible medir los movimientos del calcio en las células. Estas mediciones revelaron que los astrocitos utilizan las fluctuaciones en sus niveles de calcio para comunicarse entre sí y con otras células en respuesta a ciertas moléculas de su entorno, como un exceso de neurotransmisores (véase «Señales de las estrellas»). Estas señales de calcio, que se mueven lentamente en comparación con las que pasan entre neuronas, tienen importantes consecuencias. Impulsan numerosas actividades, como la liberación de nuevas moléculas de señalización, iones, metabolitos y otros factores que afectan el comportamiento de las neuronas, otras células gliales y los vasos sanguíneos.
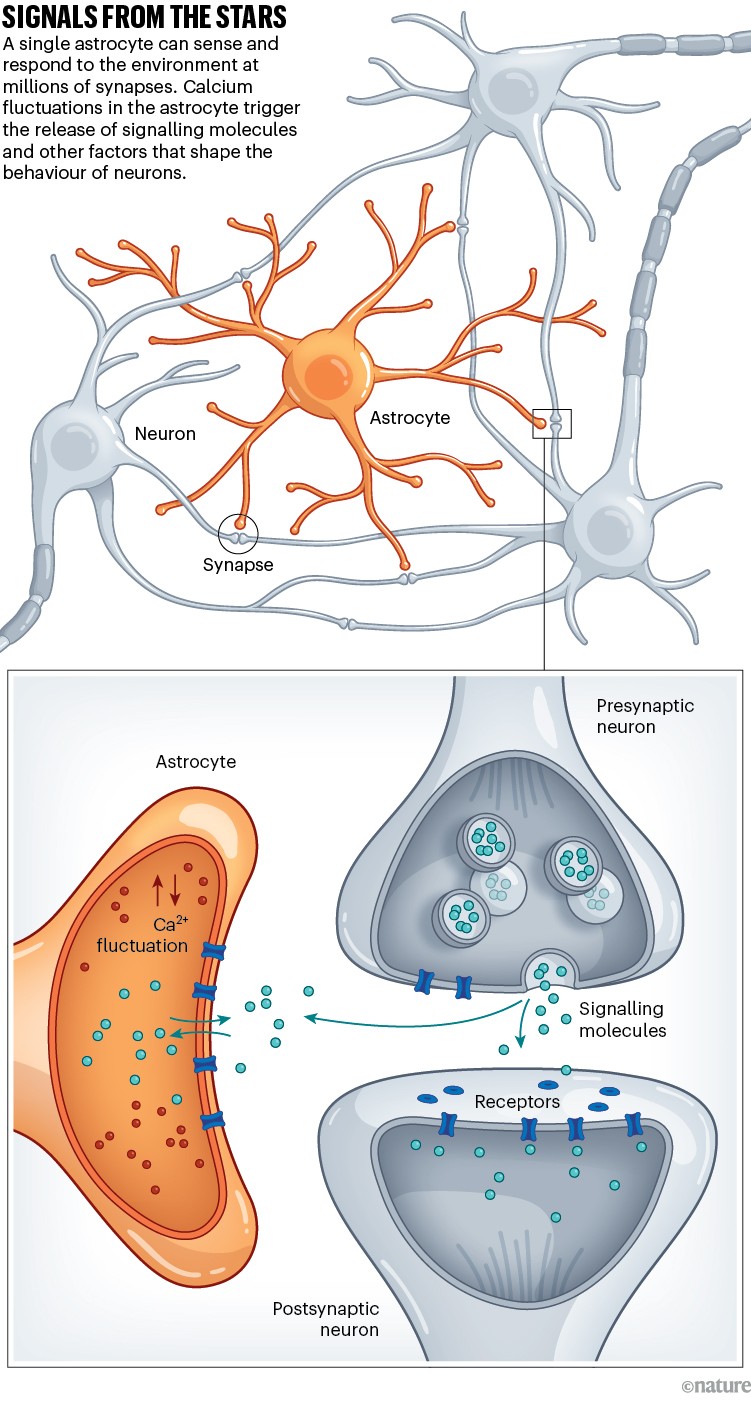
Dado que muchas de las moléculas de señalización son neurotransmisores, un pequeño grupo de investigadores comenzó a preguntarse en la década de 2010 si los astrocitos podrían contribuir a la transmisión eléctrica ultrarrápida en las neuronas . Sin embargo, durante la última década, herramientas de investigación cada vez más precisas han revelado una historia diferente y más compleja. Muchos científicos que antes se centraban exclusivamente en las neuronas ahora utilizan estas herramientas para investigar cómo los astrocitos contribuyen a la fisiología y el comportamiento animal.
No se ha encontrado evidencia que respalde la función de los astrocitos en la neurotransmisión ultrarrápida. En cambio, cada vez es más evidente que los astrocitos orquestan la mezcla molecular en el entorno que rodea las sinapsis en escalas de tiempo mucho más lentas que la señalización neuronal, variando dicha mezcla según el estado cerebral (por ejemplo, su nivel de alerta o vigilia). Esto, a su vez, puede determinar si las neuronas se activan en respuesta a una señal que llega a través de la sinapsis.
Los avances en microscopía han demostrado la estrecha relación entre los astrocitos y las neuronas. Más allá de su núcleo estrellado, los astrocitos presentan una arquitectura intrincada con numerosas ramificaciones que se extienden hacia estructuras diminutas y delicadas, llamadas folíolos, de tan solo decenas de nanómetros de ancho. Con esta resolución, los astrocitos, que constituyen una cuarta parte de todas las células cerebrales, se parecen menos a estrellas y más a esferas densas, y ocupan todo el espacio disponible entre las neuronas sin superponerse entre sí . 2 En el cerebro humano, cada astrocito puede establecer hasta dos millones de sinapsis. Además, existen diferentes tipos de astrocitos en distintas áreas cerebrales . 3
Esta vasta extensión de los astrocitos tiene profundas consecuencias en el cerebro, afirma el neurocientífico Baljit Khakh, de la Universidad de California en Los Ángeles. «En biología, la forma sigue a la función». Su laboratorio ha desarrollado muchas de las herramientas moleculares y genéticas que permiten activar o desactivar determinadas vías de señalización del calcio en los astrocitos, lo que permite a los científicos comprender la función de cada vía.
Las neuronas podrían transmitir las señales que impulsan la función cerebral, pero ahora está claro que los astrocitos afinan esas señales alterando el entorno que rodea las sinapsis, afirma el neurocientífico Hongkui Zeng, director del Instituto Allen de Ciencias del Cerebro en Seattle, Washington. «Por eso es importante aprender sobre todas las células cerebrales, no solo sobre las neuronas».
Relojes, aprendizaje y memoria
Como solo un ejemplo, los astrocitos resolvieron una pregunta abierta en el campo de la biología circadiana: ¿cómo mantiene su ciclo el reloj biológico maestro, un grupo de células cerebrales llamado núcleo supraquiasmático (NSQ), que regula los ciclos biológicos a un ritmo de aproximadamente 24 horas? «Era un misterio», afirma el biólogo circadiano Michael Hastings, del Laboratorio de Biología Molecular de Cambridge, Reino Unido.
El sistema del reloj maestro está compuesto casi exclusivamente por neuronas que liberan el neurotransmisor inhibidor GABA, y nadie podía concebir cómo un sistema que aparentemente solo suprime la actividad neuronal podía crear un ciclo diario. Los relojes biológicos necesitan un mecanismo de retroalimentación para generar ciclos rítmicos de forma autónoma, sin necesidad de una señal externa diaria para reiniciarlos.
Hace diez años, Marco Brancaccio, investigador postdoctoral de Hastings, leyó sobre un detector de glutamato: una sonda fluorescente llamada «detector de pegamento» o iGluSnFR. Brancaccio propuso usar el detector para detectar cualquier posible presencia de glutamato en los cortes de cerebro de ratón que el equipo estaba estudiando.
"Le dije a Marco que sería una pérdida de tiempo, porque no habría", recuerda Hastings. "Por suerte, me ignoró".
Brancaccio, quien ahora trabaja en el Imperial College de Londres, encontró abundante glutamato y, para sorpresa general, descubrió que sus niveles eran tan rítmicos como los de GABA. Sin embargo, mientras que los niveles de GABA eran más altos durante el día, los de glutamato alcanzaban su punto máximo por la noche .
Nos preguntamos con curiosidad. ¿De dónde podría provenir ese glutamato? —dice Hastings. No tardaron en descubrir, mediante una búsqueda bibliográfica, que la fuente debían ser los astrocitos, un tipo de célula en el que no habían pensado mucho antes.
Esto impulsó a los investigadores a realizar una serie de experimentos cada vez más sofisticados. Finalmente, concluyeron que los astrocitos contribuyen al reloj del SCN activando sus sistemas de captación de GABA durante el día y desactivándolos durante la noche 4 , 5 .
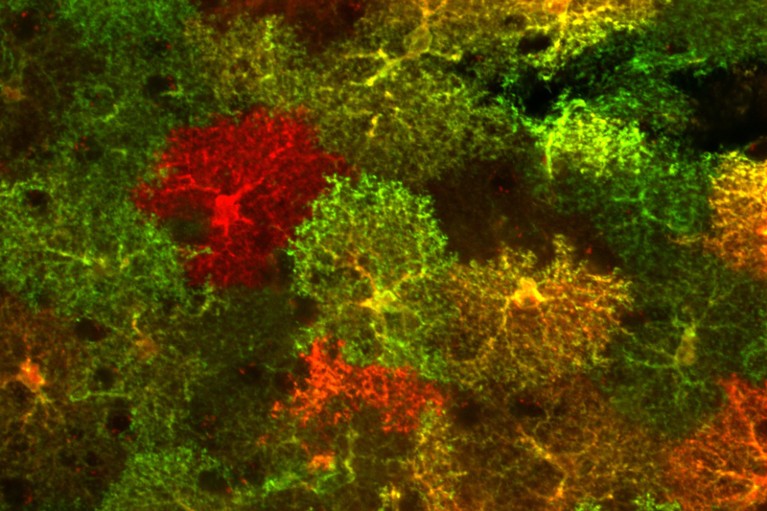
Diferentes tipos de astrocitos, con sus miles de ramificaciones y folíolos, se agrupan para llenar el cerebro. Crédito: Laboratorio B. Khakh.
Particularmente intrigantes son los estudios que están revelando cómo los astrocitos apoyan las muchas sutilezas del aprendizaje y la memoria . En uno de sus primeros experimentos clave con las nuevas herramientas, Goshen y su equipo se sorprendieron al descubrir cómo los astrocitos en los cerebros de los ratones codifican información sobre la ubicación espacial de las recompensas. Cuando un ratón ya había aprendido dónde encontrar una recompensa de agua, la actividad del calcio en sus astrocitos aumentó gradualmente a medida que se acercaba a la recompensa, descubrieron los científicos. Pero los investigadores no midieron ningún aumento cuando el ratón se movió hacia la misma recompensa en un nuevo entorno . El hallazgo plantea preguntas interesantes sobre cómo los astrocitos están involucrados en la codificación de la memoria espacial.
A principios de este año, grupos en Japón y Estados Unidos informaron que los astrocitos ayudan con la estabilización y el recuerdo de recuerdos preparados por el miedo 7 , 8 . Debido a que las señales de los astrocitos son mucho más lentas que las señales eléctricas de las neuronas, a veces se desarrollan durante horas o incluso días en lugar de milisegundos, son muy adecuados para cerrar la brecha de tiempo entre el aprendizaje y el recuerdo, dice el neurocientífico Jun Nagai en el Centro RIKEN para la Ciencia del Cerebro en Wako, Japón, quien dirigió uno de los estudios. "Piense en ellos como la cámara de larga exposición del cerebro: capturan el rastro de eventos significativos que de otro modo podrían desvanecerse demasiado rápido".
Debido a que las neuronas y los astrocitos trabajan juntos para procesar información, los investigadores han comenzado a preguntarse si los astrocitos impulsan o exacerban enfermedades que generalmente se consideraban neuronales.
Khakh no duda de ello. Mediante una combinación de técnicas, su equipo ha demostrado en ratones que la activación o el bloqueo de determinadas señales de calcio en los astrocitos puede promover o suprimir comportamientos característicos de algunas afecciones psiquiátricas , como el trastorno obsesivo-compulsivo. Los astrocitos parecen modificar los circuitos neuronales que impulsan estos comportamientos y, por lo tanto, podrían ser objetivos terapéuticos, afirma Khakh.
Los astrocitos también podrían tener potencial como dianas terapéuticas para enfermedades neurológicas, aunque no proporcionen curas completas. El equipo de Khakh se ha centrado en la enfermedad de Huntington , causada por una mutación en un solo gen. Es una enfermedad neurodegenerativa devastadora que se caracteriza por síntomas psiquiátricos, cognitivos y motores.
Utilizando un modelo murino de la enfermedad y analizando datos humanos, el equipo identificó un conjunto de genes en los astrocitos del cuerpo estriado cerebral que muestran una expresión reducida en la enfermedad de Huntington 10 . Estos genes estaban involucrados principalmente en el mantenimiento del entorno extracelular que soporta las neuronas. Cuando los investigadores utilizaron herramientas moleculares para potenciar la expresión de algunos de estos genes en ratones, se corrigieron ciertos comportamientos. Los hallazgos podrían ser clínicamente relevantes para el tratamiento de los síntomas psiquiátricos y cognitivos en etapa temprana de la enfermedad de Huntington, incluyendo dificultad con la atención y la planificación, apatía y depresión, dice Khakh.
“Las neuronas claramente impulsan la enfermedad, pero los desarrolladores de fármacos no deberían centrarse únicamente en las neuronas porque, por definición, existen en un tejido que es en sí mismo disfuncional”, afirma.
Lo mismo podría decirse de la enfermedad de Alzheimer . Esta afección neurodegenerativa común, caracterizada por la presencia de placas amiloides en el cerebro, se sabe desde hace tiempo que afecta a la microglía, que libera moléculas inflamatorias para intentar eliminar las placas. La inflamación resultante se vuelve cada vez más inútil a medida que la enfermedad avanza, y la propia inflamación comienza a contribuir a la destrucción tisular.
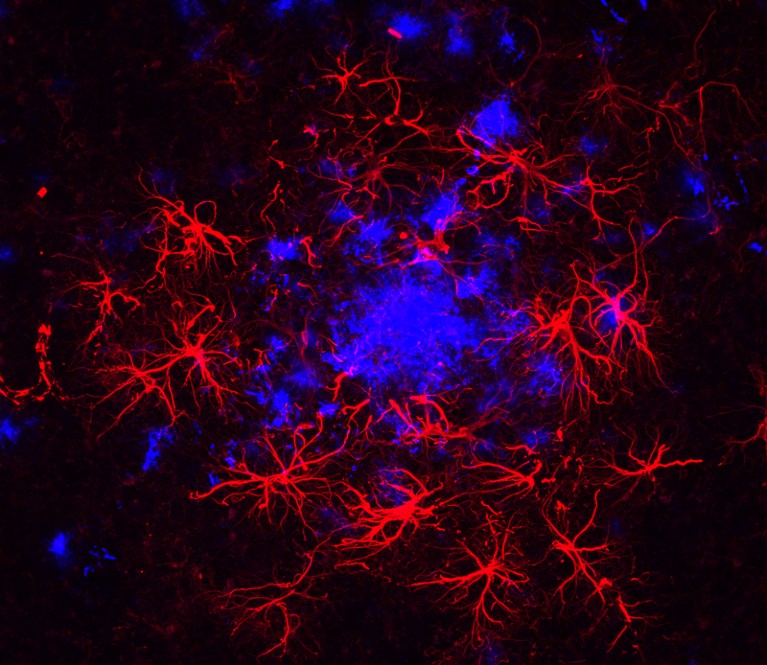
Los astrocitos (rojos) parecen estar involucrados en la enfermedad de Alzheimer. Aquí se muestran alrededor de una placa amiloide (azul). Crédito: Laboratorio B. Khakh.
El neurocientífico Bart De Strooper, del University College de Londres, y su equipo han revelado en un modelo murino de la enfermedad de Alzheimer que los astrocitos y la microglía operan juntos casi como una sola unidad para acelerar esta destrucción 11 . El equipo también ha demostrado que los astrocitos podrían estar involucrados al comienzo de la enfermedad, mucho antes de que se formen las placas. En esta etapa inicial, las neuronas se vuelven patológicamente hiperactivas y las señales de calcio en los astrocitos disminuyen al mismo tiempo. Cuando el equipo utilizó una herramienta molecular para corregir esta disminución del calcio, la actividad neuronal se normalizó y los ratones ya no mostraron algunos síntomas tempranos de la enfermedad, como los trastornos del sueño 12 .
En un estudio preimpreso 13 , con otro modelo animal de Alzheimer, el equipo de Goshen activó una vía de señalización de calcio en los astrocitos. Esto restauró por completo la memoria normal en ratones que mostraban signos de neurodegeneración.
Los científicos apenas están empezando a comprender los detalles de cómo interactúan las células gliales y las neuronas en el Alzheimer. "Pero creo que ya está claro que las terapias futuras deberán dirigirse a todas las células implicadas, no solo a las neuronas", afirma De Strooper.
Mejores modelos cerebrales
El entusiasmo por los astrocitos está empezando a atraer lentamente a los neurocientíficos computacionales que utilizan datos experimentales para probar teorías sobre cómo funciona el cerebro.
La mayor parte del modelado de astrocitos ha sido a pequeña escala —hasta 100 astrocitos o más junto con neuronas—, dice la neurocientífica computacional Marja-Leena Linne de la Universidad de Tampere en Finlandia. Ella y su equipo, junto con científicos del Centro de Investigación Jülich en Alemania, han construido lo que hasta ahora es el simulador de astrocitos más completo, incorporando datos moleculares, celulares, morfológicos y de conectividad de diversas fuentes. Los científicos han integrado esta herramienta en una plataforma digital que incluye otras herramientas para simular redes neuronales. (La plataforma cuenta con el apoyo de EBRAINS, una infraestructura europea para la investigación en neurociencia en el Centro de Supercomputación Jülich). Los neurocientíficos ahora pueden usar cualquier dato de conectividad para modelar hasta un millón de astrocitos y neuronas 14 .
Algunos investigadores que llevan décadas trabajando con astrocitos especulan sobre su posible papel evolutivo en el desarrollo de las capacidades cognitivas especiales de los humanos. «Gran parte de la avalancha de datos recientes concuerda con esta especulación», afirma el biólogo de astrocitos Alexej Verkhratsky, de la Universidad de Manchester (Reino Unido). Los astrocitos humanos son estructuralmente más complejos que los de monos y roedores; las células similares a los astrocitos en las moscas son aún más simples. Un astrocito humano cubre un volumen al menos un orden de magnitud mayor que el de su homólogo de rata y tiene diez veces más ramificaciones.
Esto parece traducirse en inteligencia, afirma Verkhratsky. La neurobióloga Maiken Nedergaard, del Centro Médico de la Universidad de Rochester en Nueva York, y sus colegas injertaron astrocitos humanos en ratones y descubrieron que los astrocitos humanos integrados conservaban su gran tamaño y complejidad, y que los ratones quiméricos eran notablemente más inteligentes que los ratones de control en diversas tareas de memoria . 15
Tras décadas en la sombra, los astrocitos están abriendo numerosas vías de investigación. «La cantidad de literatura que surge actualmente de diferentes laboratorios que trabajan en distintas áreas ha llevado a la mayoría de los escépticos a comprender que los astrocitos están haciendo algo que merece la pena considerar», afirma Allen.
Original en:Naturaleza 648 , 23-25 (2025)
doi: https://doi.org/10.1038/d41586-025-03912-w