Los neurocientíficos están
analizando enormes cantidades de datos para aprender cómo los cerebros crean
emociones u otros estados internos como la agresión y el deseo.
Hace dos años, Jennifer Li y
Drew Robson buscaban a través de terabytes
de datos de un experimento de cerebro de pez cebra, cuando se encontraron con
un puñado de células que parecían ser psíquicas.
Los dos neurocientíficos habían
planeado mapear la actividad cerebral, mientras las larvas de pez cebra
buscaban comida, y registrar cómo cambiaba la charla neuronal. Fue su primera
prueba importante de una plataforma tecnológica que habían construido en la
Universidad de Harvard en Cambridge, Massachusetts. La plataforma les permitió
ver cada neurona en el cerebro de las larvas mientras las criaturas, apenas del
tamaño de una pestaña, nadaban libremente en un plato de agua de 35 milímetros
de diámetro, y se dedicaban a comer su alimento microscópico.
De la montaña de datos de los
científicos emergió un puñado de neuronas que predijeron cuándo una larva iba a
atrapar y tragar un bocado. Algunas de estas neuronas incluso se activaron
muchos segundos antes de que la larva fijara sus ojos en el grumo de plancton.
Y algo extraño. Al observar
con más detalle los datos, los investigadores se dieron cuenta de que las
células "psíquicas" estuvieron activas durante un tiempo inusualmente
largo, no segundos, como es típico en la mayoría de las neuronas, sino muchos minutos.
De hecho, más o menos la duración de los episodios de alimentación de las larvas.
Li y Robson investigaron en
las publicaciones científicas y poco a poco se dieron cuenta de que las células
debían estar estableciendo un "estado cerebral" general, un patrón de
actividad cerebral prolongada que preparaba a las larvas para interactuar con
la comida frente a ellas. La pareja se enteró de que, en los últimos años,
otros científicos que utilizaban varios enfoques y diferentes especies también
habían encontrado estados cerebrales internos que alteran el comportamiento de
un animal, incluso cuando nada ha cambiado en su entorno externo.
Algunos, como Li y Robson,
habían llegado al descubrimiento por casualidad mientras revisaban sus propios
datos de todo el cerebro. Otros han planteado la hipótesis de que deben existir
neuronas que codifican estados cerebrales internos, y las han buscado
activamente en regiones cerebrales discretas y bien investigadas. Por ejemplo, el neurobiólogo David Anderson del Instituto
de Tecnología de California (Caltech) en Pasadena y sus colegas identificaron
un estado interno del cerebro, representado por una pequeña red de neuronas,
que prepara a las moscas de la fruta para participar en conductas de cortejo o
pelea.
Los neurocientíficos que intentan
comprender el lenguaje de codificación del cerebro han estudiado
convencionalmente cómo responden sus redes de neuronas a la información
sensorial y cómo generan comportamientos, como el movimiento o el habla. Pero
no pudieron analizar en detalle la parte importante: la gran cantidad de
actividad neuronal que ocultan patrones que representan el estado de ánimo o
los deseos del animal, y que lo ayudan a calibrar su comportamiento. Incluso
hace unos pocos años, medir las actividades de redes específicas que subyacen a
los estados internos del cerebro era imposible.
Una gran cantidad de nuevas
técnicas están comenzando a cambiar eso. Estos métodos permiten a los
científicos rastrear la actividad eléctrica en el cerebro con un detalle sin
precedentes, cuantificar el comportamiento natural de un animal en escalas de tiempo
de milisegundos y encontrar patrones en las montañas de datos que generan estos
experimentos. Estos patrones podrían ser firmas de los innumerables estados
internos que puede adoptar un cerebro. Ahora el desafío es descubrir qué
significan estos estados.
 |
Escaneo a través de un cerebro de pez cebra con neuronas clasificadas funcionalmente resaltadas en color
Tres grupos de neuronas controlan cuándo las larvas de pez cebra
se quedan quietas (izquierda), exploran (centro) y cambian entre los dos estados (derecha).
Imagen: J. C. Marques et al./Naturaleza
|
Algunos neurocientíficos se
atreven a utilizar las tecnologías para estudiar un poderoso grupo de estados internos del cerebro:
las emociones. Otros las están aplicando a estados como la motivación o a impulsos existenciales como la sed. Los
investigadores incluso están encontrando en sus datos firmas de estados para los que no tienen
vocabulario asociado.
Estados de ánimo
El cerebro de cualquier
animal es bombardeado constantemente con información sobre el entorno del
animal desde órganos sensoriales como
los ojos, los oídos, la nariz o la piel. Toda esta información se procesa
inicialmente en la corteza sensorial del cerebro. Luego vienen pasos de
procesamiento más misteriosos, en los que esa información se filtra a través de
múltiples estados internos del cerebro que representan los estados de ánimo y
las necesidades en constante cambio del animal. Eso finalmente lleva a la
corteza motora a generar movimientos que son apropiados a las circunstancias,
para alejar una mosca que molesta, por ejemplo, o moverse hacia un sabroso
manjar. Los estados internos también se pueden generar completamente en el
cerebro, sin entrada sensorial y sin salida de comportamiento: piense en soñar
despierto o en la reproducción de los eventos del día en su mente.
En los últimos años, la
comprensión de la naturaleza de los estados internos está cambiando la forma en
que los neurocientíficos que estudian las redes cerebrales piensan sobre el
comportamiento animal. “Solíamos pensar en los animales como una especie de
máquinas de respuesta a estímulos”, según la neurocientífica Anne Churchland del
Laboratorio Cold Spring Harbor, Nueva York. "Ahora estamos empezando a
darnos cuenta de que se están generando todo tipo de cosas realmente interesantes
dentro de sus cerebros que cambian la forma en que se procesan las entradas
sensoriales y, por lo tanto, cambia la salida de comportamiento de los
animales".
Esbozar cómo estudiar este
intrigante paso intermedio ha sido
durante mucho tiempo una preocupación para Anderson. Hace seis años, decidió
crear un marco teórico para la investigación de los estados internos del
cerebro que representan la emoción. Estaba molesto por la opinión de algunos
psicólogos, que piensan que debido a que los animales no pueden expresar sus
sentimientos con palabras, esos sentimientos no pueden estudiarse en absoluto.
Junto con su colega de Caltech Ralph Adolphs, Anderson desarrolló y publicó una
hipótesis sobre las características que deberían tener los circuitos neuronales
asociados con los estados internos del cerebro.
Lo más importante, pensaron,
es que un estado cerebral interno debería durar más que el estímulo original
que lo desencadenó. Entonces, una característica clave de un circuito neuronal
que sustenta tal estado sería su persistencia, dice. “Si va de excursión a las
montañas y ve una serpiente, entonces puede saltar de miedo”, según Anderson.
"Diez minutos después, el estado interno de miedo de tu cerebro todavía
está activo, así que cuando veas un palo en tu camino, podrías saltar de
nuevo".
Otras características de los
estados internos deben incluir la generalización, lo que significa que
diferentes estímulos deben poder provocar el mismo estado, y la escalabilidad,
en la que diferentes estímulos pueden crear estados de diferente intensidad.
Anderson y Adolphs publicaron
su artículo en 2014, justo cuando una serie de neurotecnologías comenzaba a
hacer factibles los experimentos necesarios. Ya era posible registrar una gran
cantidad de neuronas individuales al mismo tiempo, y desde entonces las
tecnologías han mejorado y se han expandido notablemente, lo que permite a los
científicos analizar la actividad anteriormente inaccesible.
Liderando estas técnicas está
la sonda Neuropixels, de solo 10 mm de largo, que puede registrar directamente
la actividad en cientos de neuronas en diferentes áreas del cerebro. Y las
técnicas de imágenes especiales pueden indicar dónde están activas hasta decenas
de miles de neuronas individuales en todo el cerebro. En las imágenes de
calcio, por ejemplo, los animales se diseñan genéticamente para expresar una
molécula en sus neuronas que detecta los iones de calcio; cuando estos se introducen
en una neurona cuando se excita, la molécula emite fluorescencia.
Los nuevos monitores de
comportamiento automáticos toman grabaciones de vídeo de animales que se
comportan libremente durante muchas horas y analizan cada movimiento en
elementos de milisegundos. Luego, los elementos se pueden alinear con
grabaciones neuronales, haciendo coincidir la actividad cerebral momento a
momento con movimientos específicos.
Los neurocientíficos han
capitalizado el aumento en el aprendizaje automático, la inteligencia
artificial y las nuevas herramientas matemáticas para dar sentido a los
gigabytes o terabytes de datos que puede generar cualquier experimento con
estas tecnologías y para detectar los patrones de activación neuronal que
podrían representar estados cerebrales internos.
Listo para participar
Para su primer estudio de un
estado interno, Anderson decidió aprovechar el interés previo de su laboratorio
por la agresión en la mosca de la fruta, que tiene un cerebro diminuto que
contiene alrededor de 100.000 neuronas. En muchas especies animales, los machos
comienzan a pelear entre sí en presencia de hembras, un comportamiento bien
establecido que Anderson llama el "efecto Helena de Troya", en honor
al mito griego sobre una mujer cuyos pretendientes competidores iniciaron una
guerra. Las moscas de la fruta no son una excepción: la evidencia indirecta
sugiere que la exposición a las hembras hace que los machos se involucren tanto
en canciones de cortejo como en comportamientos agresivos hacia otros machos
durante muchos minutos y eso es mucho tiempo en la corta vida de una mosca de
la fruta.
Anderson empezó a buscar la
actividad neuronal que se correlacionara con el cortejo persistente y los
comportamientos de lucha iniciados por las neuronas conocidas como P1, que se
encuentran en una región que controla dichos comportamientos sociales. Estas
neuronas se activan tan rápido que por sí solas no podrían ser responsables de
mantener un estado interno. Usando técnicas de imagen junto con análisis de
comportamiento automatizados, su grupo identificó células en otras áreas del
cerebro que se activan como consecuencia de la activación de P1.
La mayoría de estas
"células seguidoras" se activaron y desactivaron rápidamente, pero un
grupo llamado neuronas pCd permaneció activo durante muchos minutos. Cuando los
investigadores insertaron una proteína sensible a la luz en estas células y las
apagaron usando un flash de un láser, el efecto persistente de la activación de
P1 en el comportamiento desapareció. Cuando las activaron directamente, sin
pasar por P1, no sucedió nada: las neuronas pCd necesitaban P1 como disparador
y, una vez que se activaron, permanecieron activadas durante mucho más tiempo
que la indicación inicial. Si Anderson tuviera que darle un nombre al estado,
podría llamarlo el estado "listo para participar en estos comportamientos
sociales".
Su equipo ha realizado un
experimento similar en ratones, que tienen cerebros más complejos, que
contienen alrededor de 100 millones de neuronas. Los investigadores encontraron
un grupo particular de neuronas en el hipotálamo que, al igual que las neuronas
pCd, se activaron persistentemente en asociación con un impulso innato, esta
vez, el miedo. Cuando los científicos colocaron una rata cerca de ratones de
experimentación durante solo unos segundos, los ratones respondieron a la
defensiva pegándose a la pared durante varios minutos y el grupo de neuronas
permaneció activo durante todo este tiempo. Cuando el equipo volvió a utilizar
la luz para encender y apagar las neuronas, el comportamiento de pegarse a la
pared, vino y se fue en tándem, incluso sin la presencia de ratas.
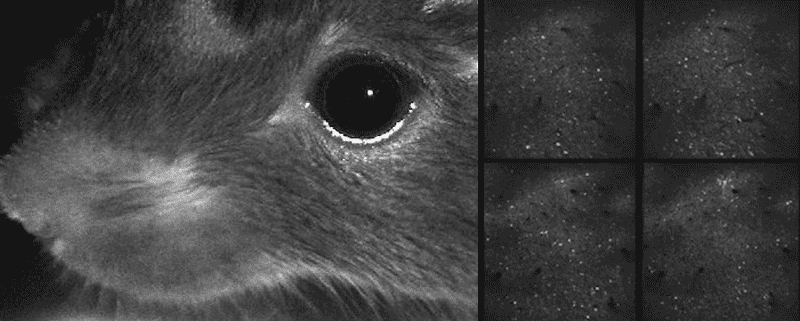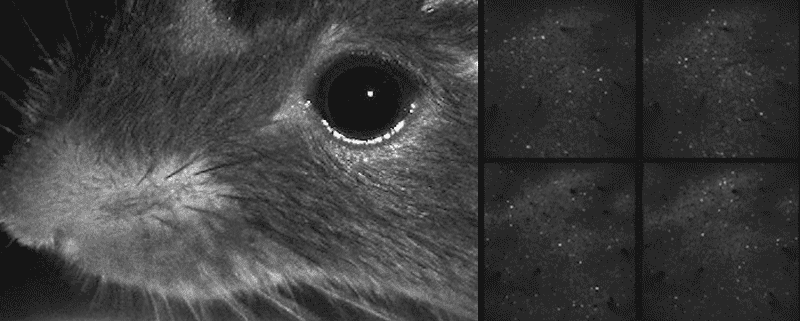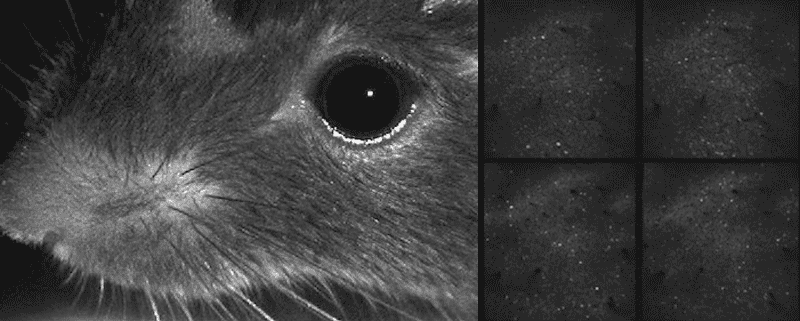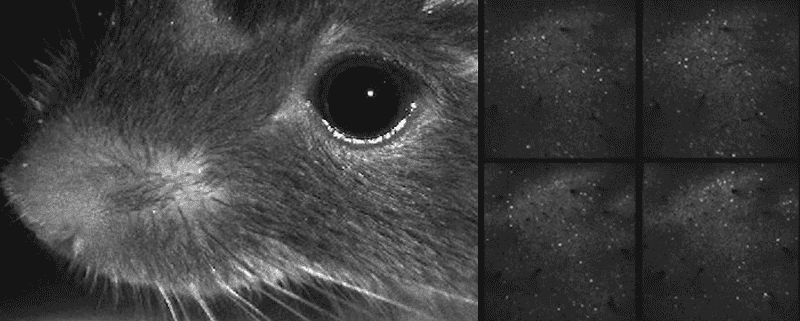 |
Video del ratón moviendo sus bigotes y actividad neuronal mostrada simultáneamente
Incluso durante una tarea, este ratón dedica
la mayor parte de su actividad cerebral a mover sus bigotes.
Imagen: C. Stringer et al./Science
|
Los neurocientíficos están
descubriendo ahora otros grupos de neuronas con actividad persistente en
diferentes áreas del cerebro. Utilizando imágenes de calcio en ratones, Andreas
Lüthi del Instituto Friedrich Miescher de Investigación Biomédica en Basilea,
Suiza, y Jan Gründemann de la Universidad de Basilea buscaron en la amígdala,
que es fundamental para la regulación de una variedad de emociones y comportamientos.
El equipo encontró dos poblaciones diferentes de neuronas que mostraban una
activación sostenida pero opuesta cuando los ratones cambiaban entre dos
comportamientos distintos: explorar el entorno y realizar comportamientos
defensivos como la inmovilidad.
Gründemann reconoce que es
poco probable que las células de la amígdala funcionen de forma aislada, y que neuronas
de todo el cerebro deben participar en el mantenimiento de los estados de
exploración o defensa. “Estoy seguro de que lo que hemos encontrado es solo un nodo en redes más grandes que abarcan
todo el cerebro”.
La imagen completa
Mientras que muchos investigadores han buscado neuronas que tengan actividad
duradera en áreas concretas del cerebro, Li y Robson, que se mudaron a Alemania
en septiembre pasado para dirigir conjuntamente un laboratorio en el Instituto
Max Planck de Cibernética Biológica en Tübingen, encontraron sus neuronas
persistentemente activas casi por casualidad.
Sus larvas de pez cebra son menos complejas que las moscas de la fruta, ya que
solo tienen 80.000 células cerebrales. Debido a que estos peces bebés son transparentes,
la actividad de casi todas sus neuronas se puede monitorear simultáneamente
usando imágenes de calcio.
La pareja ha desarrollado un método para seguir simultáneamente los movimientos
y la actividad neuronal mientras las larvas de peces nadan libremente alrededor
de un plato con agua. Implementan un sistema de seguimiento de microscopio
fluorescente que se mueve en su plataforma de imágenes para mantener a los
peces a la vista de forma constante y captura cada destello de cada neurona a
medida que las larvas se mueven. El sistema también los graba, por lo general
durante 90 minutos, generando 4,5 terabytes de datos, lo que permite a los
experimentadores alinear el movimiento con la actividad neuronal segundo a
segundo.
Es posible que las larvas de peces no parezcan tener la rica vida interna que
disfrutan los ratones, o incluso las moscas, pero tienen al menos una sólida
elección de comportamiento que tomar en sus vidas: alimentarse localmente o
nadar en aguas desconocidas para buscar nuevos alimentos. Cuando Li y Robson
observaron a las larvas que tomaban esta decisión, encontraron tres grupos de
neuronas: uno que estaba persistentemente activo durante la alimentación local,
otro que permanecía activo durante la exploración y un tercero que parpadeaba
brevemente cuando el pez cambiaba de estado. Sorprendentemente, el hambre no
pareció influir en los estados, que cambiaban automáticamente cada pocos
minutos, al igual que nuestros propios estados de sueño-vigilia cambian
automáticamente, pero en una escala de tiempo mucho más corta.
Los neurocientíficos que trabajan con organismos más complejos no pueden
controlar todo el cerebro a la vez, pero han podido encontrar indicios de
estados cerebrales internos con redes que están ampliamente distribuidas en el
cerebro. En experimentos técnicamente desafiantes, en ratones, han registrado
la actividad de miles de neuronas en todo el cerebro usando imágenes de calcio,
y de cientos de neuronas usando un solo electrodo de Neuropixels, varios de los
cuales pueden insertarse a la vez.
En un estudio reciente, el neurocientífico Karl Deisseroth de la Universidad de
Stanford en California y su equipo utilizaron sondas Neuropixels para registrar
la actividad de 24.000 neuronas en 34 regiones cerebrales corticales y
subcorticales en ratones sedientos que lamían agua de un pico. Los científicos
pudieron descubrir señales relacionadas con el estado de sed del cerebro a
partir de señales relacionadas con el comportamiento de lamer. Descubrieron que
estas neuronas de señalización de estado se activaban en todo el cerebro, no
solo en el hipotálamo, donde se encuentran las neuronas dedicadas a la sed.
Usando estas extensas técnicas de grabación, los neurocientíficos están
descubriendo que suceden muchas cosas debajo de la superficie cuando un animal
realiza una tarea, y no todo parece relevante a primera vista. En artículos
históricos recién publicados, grupos dirigidos por Kenneth Harris y otros, en el University College London, demostraron
que cuando un ratón se dedica a una tarea, las neuronas se activan en todo el
cerebro, pero que una gran proporción de la activación no está correlacionada
con la tarea en absoluto. Alguna actividad se correlacionó con los movimientos de
los animales. Pero alrededor de dos tercios de la activación no coincidió con
ningún movimiento o acción.
Cerebro activo
Muchos neurocientíficos dicen que el gran volumen de datos que surgen de los
experimentos de todo el cerebro es también el mayor cuello de botella para la
investigación. Pero se ha progresado en el desarrollo de técnicas para filtrar
la avalancha de mediciones. Un enfoque popular es utilizar un método matemático
llamado modelo de Markov oculto (hidden Markov model o HMM) para predecir la probabilidad de que un
sistema cambie entre diferentes estados en un momento determinado.
Mala Murthy de la Universidad de Princeton, Nueva Jersey, y sus colegas
utilizaron el HMM para descubrir ritmos en el cerebro de los machos de la mosca
de la fruta que influyeron en su elección del patrón de canto al cortejar a las
hembras. El hecho de que las moscas machos elijan momento a momento cantar en
pulsos entrecortados o zumbidos más largos depende en gran parte, pero no
totalmente, de cómo responden las hembras a ellos. El grupo de Murthy descubrió
que tres estados cerebrales internos diferentes también afectaban a la elección
del patrón de canto por el macho. Llamaron Close, Chasing y Whatever a estos
estados cerebrales internos.
Independientemente de la
complejidad del organismo modelo que hayan adoptado los investigadores
individuales (gusano, pez, mosca o ratón), la cuestión de cómo todo el cerebro
coordina los estados internos "es en lo que todos estamos centrando
nuestros experimentos", según Steve
Flavell del Instituto de Tecnología de
Cambridge. En 2013, Flavell y sus colegas descubrieron que incluso el cerebro
del gusano Caenorhabditis elegans, que tiene solo 302 neuronas, muestra propiedades
de estados cerebrales internos que impulsan comportamientos particulares,
incluidos dos conjuntos de neuronas persistentemente activas que controlan si
el animal permanece quieto o se mueve a propósito. Desde entonces, su grupo ha
identificado todos los circuitos involucrados en los dos estados y el cambio
entre ellos.
Aparte de sus preguntas sobre
la biología básica, los investigadores tienen en cuenta el beneficio clínico de
comprender cómo se manifiesta un estado particular en el cerebro. Aquellos que
estudian el dolor en modelos de roedores, por ejemplo, se basan en pruebas
estándar, como observar cuando una rata levanta la pata de una superficie que
quema. "Ese movimiento refleja los aspectos protectores del dolor, pero no
la percepción real del dolor", según el neurólogo Clifford Woolf del
Boston Children's Hospital en Massachusetts. Eso lo convierte en un modelo
pobre para el dolor, argumenta, porque está a un paso de la sensación real. Este
investigador ha lanzado un estudio para
intentar leer directamente las señales cerebrales que indican el estado interno
de la percepción del dolor, una lectura potencialmente más oportuna y
específica que la de esperar la respuesta del animal.
En este nuevo campo, incluso
lo básico está por definir, según Li. "En esta etapa, todavía estamos
tratando de comprender cuáles son las preguntas".
Basado en:
Marques, J. C., Li, M.,
Schaak, D., Robson, D. N. & Li, J. M. Nature 577, 239–243
(2020).
Jung, Y. et al. Neuron 105, 322–333 (2020).
Anderson, D. J. & Adolphs, R. Cell 157, 187–200
(2014).
Jun, J. J. et al. Nature 551,
232–236 (2017).
Gründemann, J. et al. Science 364, eaav8736
(2019).
Allen, W. E. et al. Science 364, eaav3932 (2019).
Stringer, C. et al. Science 364, eaav7893
(2019).
Musall, S., Kaufman, M. T., Juavinett, A. L., Gluf, S. & Churchland,
A. K. Nature Neurosci. 22, 1677–1686 (2019).
Calhoun, A. J., Pillow, J. W. & Murthy, M. Nature Neurosci. 22,
2040–2049 (2019).
Flavell, S. W. et al. Cell 154, 1023–1035
(2013).
Cermak, N. et al. eLife 9,
e57093 (2020).













