Desde los intestinos y las vías respiratorias hasta la sangre, los músculos y la piel, diversos receptores sensoriales se han detectado en funciones inesperadas.
¿Qué hacen los receptores sensoriales fuera de los órganos de los sentidos? Los receptores de olor, sabor y luz están presentes en muchas partes diferentes del cuerpo y tienen funciones sorprendentemente diversas.
Berkowitz de la Universidad Johns Hopkins comenzó a observar una curiosa
respuesta en los vasos sanguíneos que había aislado para su estudio: cada vez
que entraba en su laboratorio y las luces se encendían automáticamente, los
vasos sanguíneos ejercían menos presión sobre el transductor de fuerza que los
investigadores habían conectado para transmitir datos de manera continua.
Una búsqueda en la literatura científica reveló que la relajación de los
vasos sanguíneos en respuesta a la luz, llamada fotorrelajación, se había
descrito casi 50 años antes, pero los mecanismos subyacentes nunca se habían
aclarado por completo. Berkowitz analizó si estos efectos estaban mediados por
pigmentos intrínsecos de detección de luz. Si fuera así, no sería la primera
vez que se encontrara un receptor sensorial fuera de un órgano sensorial.
La luz, el olor y los receptores del gusto ubicados en nuestros ojos,
narices y lenguas inundan nuestro cerebro con información sobre el mundo que
nos rodea. Pero estos mismos receptores sensoriales también están presentes en
lugares inesperados por todo el cuerpo, donde sirven a una sorprendente
variedad de funciones biológicas. En la última década, más o menos, los
investigadores descubrieron que el intestino "descubre" a los
parásitos antes de iniciar las respuestas inmunitarias, y los riñones
"huelen" los ácidos grasos,
regulando la presión arterial en respuesta. Por supuesto, luego de una
investigación adicional, Berkowitz descubrió que era la melanopsina, un
pigmento sensible a la luz que regula el ciclo circadiano y otras funciones no
visuales en el ojo, lo que modulaba la relajación de los vasos sanguíneos
cuando se encendían las luces de laboratorio.
Ahora los investigadores están caracterizando tales receptores
sensoriales presentes en diferentes tejidos por todo el cuerpo y trabajando
para comprender sus funciones, con el objetivo final de usar estos receptores
para diversas aplicaciones diagnósticas o terapéuticas. Se están realizando
ensayos preliminares para probar los usos terapéuticos de la vasodilatación
inducida por luz en seres humanos, por ejemplo, y los ensayos clínicos detectarán
pronto si los receptores del gusto de un paciente, tanto los de la boca como
los de las vías respiratorias, podrían usarse para diagnosticar y tratar infecciones
respiratorias, respectivamente. Si bien muchos de los detalles de la activación
de los receptores y la señalización en cascada no están claros, los
investigadores finalmente se están acercando a comprender qué hacen estos
receptores fuera de los órganos sensoriales clásicos. Y los laboratorios están
utilizando herramientas genéticas modernas, como matrices para detectar la
expresión génica o los niveles de proteínas en diferentes tejidos, para
identificarlos.
Siguiendo el olfato
 |
Sensores olfativos: originalmente se pensaba que estaba presentes solo en la nariz, pero los receptores olfativos existen en muchos lugares del cuerpo, incluso en la piel, el corazón, los pulmones, los riñones, los músculos y el esperma.
Están involucrados en una variedad de funciones, desde regular la presión arterial hasta mejorar la regeneración de los músculos y la piel.
Imagen LUCY READING-IKKANDA
En 1991, Richard Axel y Linda Buck, de la Universidad de Columbia,
describieron por primera vez la familia de genes que codifican los receptores
olfativos, iniciando el estudio molecular del olfato. La suposición en ese
momento era que los receptores olfativos sólo se expresaban en la nariz, pero
casi inmediatamente, los estudios sobre la expresión del gen del receptor en
otros tejidos comenzaron a aparecer en las publicaciones científicas. En
estudios publicados en 1992 y 1993, por ejemplo, investigadores de la
Université Libre de Bruxelles detectaron la expresión de genes de receptores
olfativos en espermatozoides de perros. Pero si estos receptores eran
funcionales, era una pregunta sin respuesta hasta el momento.
Intrigado, Hanns Hatt de Ruhr-University Bochum decidió buscar estos
receptores en el esperma humano. En 2003, Hatt y sus colegas demostraron que
los receptores olfativos en los espermatozoides humanos eran funcionales y
podían ser activados por una molécula de olor, al igual que los receptores en
la nariz. Aún así, al principio fue muy difícil convencer al mundo científico
de que estos receptores olfativos no se expresan exclusivamente en la nariz.
Durante la siguiente década, el equipo de Hatt y otros continuaron
identificando los receptores olfativos en una variedad de tejidos humanos,
incluidos los pulmones, el hígado, la piel, el corazón y los intestinos. De
hecho, son algunos de los genes más altamente expresados en muchos
tejidos, por lo que estos receptores deben tener una enorme importancia para la
célula.
 |
Se han encontrado receptores del gusto en todo el cuerpo, incluidos los testículos, el esperma, las vías respiratorias y el intestino. Tienen muchas funciones diferentes, detectadas en ratones de laboratorio, que incluyen la detección de nutrientes en los alimentos, la regulación de la respuesta inmune a las bacterias y los parásitos e influyen en la fertilidad.
Células penacho epiteliales (Tuft Cells): los receptores del gusto se expresan en ciertas células epiteliales en el intestino, que en el ratón utilizan la señalización del gusto para detectar parásitos y estimular el sistema inmunológico en respuesta.
Células ciliadas : los receptores de sabor amargo también se expresan en las células de las vías respiratorias superiores que contienen protuberancias similares a pelos llamadas cilios. Cuando estos receptores del sabor amargo detectan las moléculas de señalización bacteriana, las células liberan óxido nítrico que mata a las bacterias. También aumentan la velocidad con que los cilios vibran para expulsar las bacterias de las vías respiratorias.
Ahora, la pregunta que se avecina es: ¿Qué están haciendo estos
receptores? El gran problema es que, para estudiar la función de las proteínas
del receptor olfatorio, uno tiene que saber cómo se puede activar el receptor.
Los seres humanos tienen unos 350 tipos de receptores olfativos
funcionales (los ratones y las ratas tienen alrededor de 1.000), y los
investigadores solo han identificado las moléculas activadoras de olor del 10
al 20 por ciento de ellas. Para descubrir qué activa un receptor en particular,
Hatt expresa su gen en una línea celular humana y expone las células a un panel
de unos pocos cientos a unos pocos miles de moléculas de olor diferentes, típicamente
olores artificiales disponibles comercialmente, como los que se usan para
perfumes u otros productos cosméticos.
Usando esta técnica, Hatt identificó con éxito una molécula de olor que activa los receptores olfativos en el esperma, un olor sintético que huele a flores de lirio de los valles, lo que le ha permitido realizar estudios funcionales. Los espermatozoides nadan hacia el odorante sintético y se aceleran a medida que aumenta la concentración de odorantes. Hatt sugiere que estos receptores olfativos podrían guiar al esperma a medida que nadan hacia el óvulo, aunque los investigadores aún están probando esta hipótesis e intentando identificar el ligando natural del receptor en el cuerpo.
 |
SIGA ESE OLOR: el tratamiento de las células de la piel humana con un aroma de sándalo artificial llamado sandalore, activa un receptor olfativo que causa un aumento de la migración celular y la proliferación, mejorando la cicatrización de las heridas. El ligando natural del receptor es desconocido.
Imagen: BUSSE ET AL., J INVEST DERMATOL, 134: 2823-32, 2014.
Hatt también descubrió que un olor a sándalo artificial llamado sandalore
activa un receptor olfativo en la piel. La activación de este receptor estimuló
a las células de la piel para migrar y proliferar más rápidamente, lo que lleva
a una regeneración y curación de heridas más rápido. Una vez más, el ligando
natural del receptor, probablemente una sustancia química u hormona con una
estructura similar a la del sándalo, aún está por determinarse.
Algunos receptores olfativos tienen funciones similares en diferentes
tejidos. En 2009, Grace Pavlath de la Universidad de Emory estaba estudiando
cómo las células musculares se fusionan para formar fibras multinucleadas
cuando notó niveles altos de expresión para el mismo receptor olfativo que Hatt
había encontrado en el esperma. Encontró que este receptor olfativo atrae a las
células musculares hacia un olor particular, dirigiendo así la migración
muscular. "Es absolutamente lógico que lo utilice como un “atractor” para
decirle a las células a dónde ir", según Pavlath. Sin este receptor, las
fibras musculares de los ratones son más propensas a las lesiones y se
regeneran de manera deficiente, mientras que la sobreexpresión de este receptor
mejora la regeneración. Encontrar el ligando natural del receptor permitiría
potencialmente diseñar fármacos que pudieran activar este receptor y mejorar la
regeneración muscular.
En algunos casos, los investigadores pueden haber identificado los
ligandos naturales responsables de la activación de los receptores olfativos en
todo el cuerpo. En el riñón, por ejemplo, Pluznick de la Universidad Johns
Hopkins encontró que ciertos ácidos grasos de cadena corta producidos por
bacterias intestinales pueden activar el receptor olfativo 78 (Olfr78), que en
ratones desencadena cambios en la presión arterial. Cuando los investigadores
inyectaron ratones que carecían del gen para Olfr78 con ácidos grasos de cadena
corta, la presión sanguínea de los animales disminuyó, lo que sugiere que
Olfr78 por sí mismo normalmente aumenta la presión sanguínea en respuesta a estos
compuestos. Pero la regulación de la presión sanguínea es complicada, y
Pluznick encontró otro receptor no olfatorio llamado Gpr41 que disminuyó la
presión sanguínea en respuesta a los ácidos grasos de cadena corta y tuvo un
efecto más fuerte que Olfr78. Pluznick sugiere que los dos receptores podrían
actuar juntos para producir un efecto de amortiguación, efecto que protegería
contra los cambios bruscos de la presión arterial, ya que los niveles de ácidos
grasos fluctúan.
"Hay indicios en la literatura científica de que las cosas que se
espera que aumenten la producción de acidos grasos de cadena corta están
asociadas con cambios en la presión arterial", según Pluznick. Las
bacterias intestinales producen ácidos grasos de cadena corta cuando los
microbios digieren alimentos ricos en fibra, por ejemplo, y comer más fibra se
ha asociado con una presión arterial más baja. Se podría suponer, entonces, que
comer alimentos con fibra, o ingerir probióticos, podría ayudar a regular la
presión arterial. Eso es, obviamente, un objetivo ideal a largo plazo, pero hay
potencial para seguir indagando en este sentido.
Los receptores olfativos en sitios inesperados también pueden resultar
útiles en el tratamiento del cáncer. Hatt ha identificado receptores olfativos
muy altamente expresados en varios tipos de células
cancerosas, y al estimularlos se reduce el tamaño de los
tumores in vitro. Aunque se necesita mucha más investigación para poder
traducir esos hallazgos en una terapia contra el cáncer, es una nueva y enorme
familia de posibles objetivos para el diagnóstico y la terapia para diferentes
enfermedades.
Relajación luminica
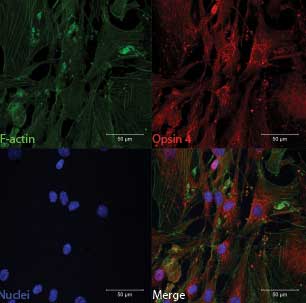 |
ILUMINANDO LA SANGRE: las células musculares lisas aórticas humanas producen melanopsina (Opsin? 4), un fotopigmento que induce la relajación de la vasculatura en respuesta a la luz azul.
Imagen: SEBASTIAN F. BARRETO ORTIZ
A fines de la década de 1990, cuando Ignacio Provencio, de la Universidad
de Virginia, comenzó a buscar la melanopsina en mamíferos, hasta ese momento
encontrada únicamente en ojos de anfibios, se consideró en gran medida como un
esfuerzo quijotesco por la mayoría de las personas en el campo de la visión. No
fue hasta el año 2000, cuando se documentó la expresión de melanopsina en la
retina humana y de ratón (específicamente, en las células de la retina
interna), que se hizo evidente que las opsinas en bastones y conos no eran los
únicos fotopigmentos sensibles en los ojos de los mamíferos. Desde entonces, en
mamíferos, la melanopsina se ha implicado en varios fenómenos inducidos por la
luz, incluida la regulación del reloj circadiano, la constricción de la pupila
en respuesta a la luz y los efectos sobre el estado de alerta, el aprendizaje y
el metabolismo.
Berkowitz y su equipo comenzaron a buscar la expresión del gen de
melanopsina, Opn4 y encontraron que era bastante ubicuo en todos los vasos
sanguíneos. Usando ratones knockout para Opn4 e inhibidores farmacológicos, los
investigadores confirmaron que la melanopsina efectivamente inducía la
relajación de los vasos sanguíneos en respuesta a la luz. Este efecto de
fotorrelajación era específico de las longitudes de onda azules de la luz,
consistente con el espectro de absorción del pigmento. El equipo de Berkowitz
también descubrió que la fotorelajación estaba regulada por el receptor quinasa2
acoplado a proteína G (GRK2). Si bien la exposición a la luz por sí sola podría
causar una relajación de los vasos sanguíneos del 20 al 25 por ciento, la
combinación de la luz con un inhibidor de GRK2 dio como resultado una
relajación del 75 al 100 por ciento.

LUZ: La melanopsina, un pigmento sensible a la luz que no participa en la visión, se expresa en muchos vasos sanguíneos diferentes. Cuando se exponen a luz de longitud de onda azul, la melanopsina y el receptor quinasa2 acoplado a proteína G (GRK2) inducen la relajación de los vasos sanguíneos. La combinación de luz y un inhibidor de GRK2 dio lugar a una relajación de los vasos sanguíneos in vitro del 75 al 100 por ciento.
Imagen: LUCY READING-IKKANDA
¿Pero cuál es la función de esta sensibilidad a la luz? La iluminación
con luz azul de las arterias de la cola de los ratones, que están lo
suficientemente cerca de la superficie para que la luz penetre, disminuye la presión
arterial en la arteria de la cola y aumenta el flujo de sangre en la cola. Sin
embargo, la mayoría de los vasos sanguíneos están muy adentro del cuerpo, donde
no estarían expuestos a la luz. Se especula que podría ser un vestigio de la
evolución. Alternativamente, podría haber otras cosas además de la luz que
activaran la melanopsina in vivo. También es posible que haya algunos procesos
metabólicos todavía desconocidos que generan luz dentro del cuerpo. Es un poco extraño,
pero sería posible.
Independientemente de su función fisiológica, Berkowitz está tratando de
aprovechar la fotorrelajación inducida por la luz para tratar enfermedades
vasculares, como el fenómeno de Raynaud. Los pacientes con Raynaud experimentan
una constricción extrema de los vasos sanguíneos en los dedos de las manos y
los pies en respuesta al frío, lo que limita la circulación y hace que estas
extremidades se sientan entumecidas y doloridas. Berkowitz sugiere que los
pacientes podrían usar guantes que emiten luz azul para mejorar su flujo sanguíneo
periférico. Esto podría inducir cierto alivio a estos pacientes que tienen un
frío y un dolor terribles.
Además, la terapia de luz podría ayudar a los recién nacidos que sufren
de hipertensión pulmonar o presión arterial alta en las arterias de sus
pulmones y corazones. Los tratamientos farmacológicos actuales tienen varios
efectos secundarios, y la luz podría ser una alternativa potencial segura, según
Berkowitz, quien actualmente está desarrollando técnicas para soslayar el hecho
de que la luz azul no penetra muy profundamente en el cuerpo. Con suerte, si
esa tecnología funciona, se podrá aprovechar para otras enfermedades en las que
la vasoconstricción es un problema importante. Cualquier tipo de proceso de
enfermedad en el que la constricción de los vasos sanguíneos sea un problema,
ya sea la diabetes, la enfermedad vascular periférica o la enfermedad de la
arteria coronaria, podría tratarse con una terapia basada en la luz.
Saboreando patógenos
 |
Sensores en el intestino: los receptores de sabor dulce y amargo expresados en células penacho(verdes) en el epitelio del intestino delgado (rojo) detectan parásitos y estimulan el sistema inmunológico como respuesta. (Núcleos teñidos en azul.)
Imagen: MICHAEL HOWITT
Otro tipo de maquinaria sensorial que se extiende por todo el cuerpo son
los receptores del gusto, que en la boca nos permiten disfrutar de una rica
paleta de sabores dulces, amargos, salados, ácidos y umami. Están en el
intestino; están en los testículos; están en el esperma. . . . El desafío es
descubrir cuál es su verdadero papel en vivo.
Algunos receptores del gusto en el intestino parecen detectar nutrientes
de los alimentos. Otros están presentes en los testículos y espermatozoides de
los ratones, y su eliminación deja a los ratones infértiles, aunque el
mecanismo es desconocido. Varios estudios recientes también indican un papel
para los receptores del gusto en la reacción inmune de nuestro cuerpo a ciertas
bacterias y parásitos.
 |
Células solitarias quimiosensibles (abajo): las células solitarias quimiosensibles
existentes en el tracto respiratorio superior expresan receptores de sabor
tanto amargo como dulce. Cuando las moléculas de señalización bacteriana
activan los receptores de sabor amargo en ratones de laboratorio, estos receptores estimulan la secreción de
péptidos antimicrobianos. Los receptores dulces inhiben habitualmente a estos
receptores de sabor amargo a menos que los niveles de glucosa bajen, lo cual es
un signo de un aumento del crecimiento bacteriano.
|
Finger estudió inicialmente los sensores químicos de los peces. Estos
animales tienen células sensoriales en su piel que son bioquímica y
estructuralmente similares a las células de nuestras papilas gustativas. En
2003, él y sus colegas demostraron que estas células, llamadas células solitarias
quimiosensibles, también están presentes en la nariz de los mamíferos. Los
investigadores identificaron células solitarias quimiosensibles que expresan
receptores de sabor amargo en el tracto respiratorio superior del ratón y
demostraron que las moléculas producidas por bacterias gramnegativas para comunicarse entre sí, activan
estos receptores y estimulan la secreción de péptidos inflamatorios que
provocan una respuesta inmune innata.
Desde el estudio de Finger, los receptores de sabor amargo se han
identificado también en células solitarias quimiosensibles de la vía aérea
superior humana, y Noam Cohen de la Universidad de Pennsylvania ha descubierto
que los receptores de sabor dulce también se expresan en esas células, y que
los dos desempeñan funciones complementarias en la inmunidad innata. La
activación de los receptores dulces con glucosa o sacarosa inhibe los
receptores amargos de la misma célula. Cohen descubrió que el nivel normalmente
bajo de glucosa en la vía aérea era suficiente para inhibir los receptores
amargos y prevenir la secreción de péptidos antimicrobianos. Las bacterias en
las vías respiratorias se alimentan de la glucosa, por lo que los niveles de
azúcar son "básicamente una medida indirecta de la cantidad de bacterias
que hay", según Cohen, "mientras más bacterias, menos glucosa".
Sospecha que a medida que las bacterias aumentan, los niveles de glucosa bajan,
liberando los receptores amargos para responder a los compuestos bacterianos.
Cohen especula que algunos pacientes con sinusitis crónica o diabetes tienen
niveles elevados de glucosa en sus vías respiratorias, lo que podría ayudar a
explicar su susceptibilidad a las infecciones respiratorias.
Otras células del sistema respiratorio superior tienen protusiones en
forma de vello llamados cilios móviles que sirven como motores para expulsar el
moco de las vías respiratorias, arrastrando bacterias e irritantes. Un equipo
de la Universidad de Iowa descubrió que estas células también expresan
receptores de sabor amargo en los cilios, que pueden detectar y responder a las
moléculas de señalización bacteriana. Al igual que los receptores amargos
encontrados en las células solitarias quimiorreceptoras, Cohen y sus colegas
hallaron que los receptores del gusto de estas células ciliadas pueden
estimular el sistema inmunitario innato al unirse a los compuestos bacterianos.
También responden aumentando la velocidad con la que vibran los cilios.
Al parecer, la respuesta de los receptores del gusto a las señales
bacterianas ocurre en segundos o minutos, lo que los convierte en una primera
línea de defensa contra los patógenos de las vías respiratorias. Como
resultado, el tipo de receptores que tenemos puede afectar la forma en que reaccionamos
ante las infecciones respiratorias superiores. Cohen estudió el T2R38, un receptor
de sabor amargo en células ciliadas, que es bastante variable en las
poblaciones humanas. Es el mismo receptor que se cree que hace que algunas
personas sean "superdegustadores", particularmente sensibles a los
compuestos amargos que se encuentran en alimentos como el brócoli y las coles
de Bruselas. Cohen sugiere que los pacientes con la versión del receptor de “superdegustador”
pueden detectar compuestos bacterianos en concentraciones muy bajas en las vías
respiratorias. El receptor "ni siquiera permite que las bacterias se
afiancen para establecer ningún tipo de colonización o infección", agrega.
Cohen y sus colegas encontraron que los pacientes con esta versión de T2R38
rara vez tienen infecciones respiratorias superiores gramnegativas, y el tipo
de receptor que posee un paciente predice el éxito de la cirugía sinusal. Según
Cohen, cuando los pacientes tienen una sinusitis crónica lo suficientemente
grave como para requerir cirugía, los que son más sensibles a los compuestos
amargos presentan mejores resultados después de la cirugía, con menos
infecciones subsiguientes y mejor respiración y sueño en comparación con los
que son menos sensibles.
Cohen sugiere que tener un paciente que pruebe una variedad de productos
químicos no tóxicos para evaluar su amargura podría servir como una herramienta
de diagnóstico barata y rápida. El objetivo final sería usar esto para tratar
de determinar a qué patógenos potenciales podría ser susceptible una persona.
Eventualmente, los investigadores podrán aprovechar los receptores del gusto
con fines terapéuticos, quizás inyectando una sustancia amarga en la nariz para
estimular una respuesta inmune innata. Cohen planea comenzar a probar compuestos
terapéuticos candidatos en ensayos clínicos este año. Si esto funciona de la
manera que se cree que podría funcionar, podría ser la primera línea de terapia
que se recibe cuando se sufre algún tipo de infección.
Los hallazgos recientes sugieren que los receptores del gusto también
pueden desempeñar un papel crítico en las respuestas inmunes en el intestino.
Los receptores del gusto se expresan en ciertas células epiteliales en el
intestino, llamadas células penacho, y "se supone que esto podría tener
algo que ver con reaccionar a los alimentos", según Michael Howitt de la
Universidad de Harvard. Pero después de ver el trabajo de Finger y Cohen,
Howitt se preguntó si el sabor también podría desempeñar un papel en la
detección de microbios.
Efectivamente, Howitt descubrió que la señalización del gusto por las
células penacho puede activarse por parásitos unicelulares y gusanos redondos
en la tripa del ratón. Aunque los receptores exactos involucrados aún no se han
descubierto, Howitt encontró que sin las moléculas clave de señalización del
sabor, el sistema inmunitario nunca reacciona y el intestino se esfuerza para
deshacerse de los parásitos. Los hallazgos plantean la posibilidad de que los sensores del gusto no sean solo una
forma de discriminar entre diferentes alimentos, sino que se habrían conservado
evolutivamente como forma de detectar un conjunto completo de microbios
diferentes.
Quedan muchas preguntas sobre los receptores sensoriales que se han
identificado en todo el cuerpo, en particular, qué los activa y qué funciones
fisiológicas cumplen. Pero con posibles aplicaciones terapéuticas en el
horizonte, es un campo que está creciendo enormemente. Hace veinte años, nadie
estaba realmente interesado en estudiar el olfato o el gusto, pero eso ha
cambiado radicalmente.
Basado en:
- L. Buck, R. Axel. “A novel multigene family may encode odorant
receptors: A molecular basis for odor recognition,” Cell, 65:175-87, 1991.
- M. Parmentier et al., “Expression of members of the putative
olfactory receptor gene family in mammalian germ cells,” Nature, 355:453-55, 1992.
- P. Vanderhaeghen et al., “Olfactory receptors are displayed on dog
mature sperm cells,” J Cell Biol, 123:1441-52, 1993.
- M. Spehr et al., “Identification of a testicular odorant receptor
mediating human sperm chemotaxis,” Science, 299:2054-58, 2003.
- 5. D. Busse et al., “A synthetic sandalwood
odorant induces wound-healing processes in human keratinocytes via the
olfactory receptor OR2AT4,” J Invest Dermatol, 134:2823-32, 2014.
- C.A. Griffin et al., “MOR23 promotes muscle regeneration and
regulates cell adhesion and migration,” Dev Cell, 17:649-61,
2009.
- C. Pichavant et al., “Decrease of myofiber branching via
muscle-specific expression of the olfactory receptor mOR23 in dystrophic
muscle leads to protection against mechanical stress,” Skelet Muscle, 6:2, 2016.
- J.L. Pluznick et al., “Olfactory receptor responding to gut
microbiota–derived signals plays a role in renin secretion and blood
pressure regulation,” PNAS, 110:4410-15,
2013.
- E.M. Neuhaus et al., “Activation of an olfactory receptor inhibits
proliferation of prostate cancer cells,” J Biol Chem,
284:16218-25, 2009.
- I. Provencio et al., “A
novel human opsin in the inner retina,” J Neurosci, 20:600-05, 2000.
- G. Sikka et al., “Melanopsin mediates light-dependent relaxation in
blood vessels,” PNAS,
111:17977-82, 2014.
- T.E. Finger at al., “Solitary chemoreceptor cells in the nasal
cavity serve as sentinels of respiration,” PNAS, 100:8981-86,
2003.
- M. Tizzano et al., “Nasal chemosensory cells use bitter taste
signaling to detect irritants and bacterial signals,” PNAS, 107:3210-15,
2010.
- R.J. Lee et al., “Bitter and sweet taste receptors regulate human
upper respiratory innate immunity,” J Clin Invest,
124:1393-405, 2014.
- A.S. Shah et al., “Motile cilia of human airway epithelia are
chemosensory,” Science, 325:1131-34,
2009.
- R.J. Lee et al., “T2R38 taste receptor polymorphisms underlie
susceptibility to upper respiratory infection,” J Clin Invest, 122:4145-59,
2012.
- M.R. Howitt et al., “Tuft cells, taste-chemosensory cells,
orchestrate parasite type 2 immunity in the gut,” Science, 351:1329-33,
2016.



