Antes
conocidos como el "pegamento del cerebro", los astrocitos se están
destacando a medida que un amplio conjunto de herramientas revela la
complejidad y la diversidad de estas células.
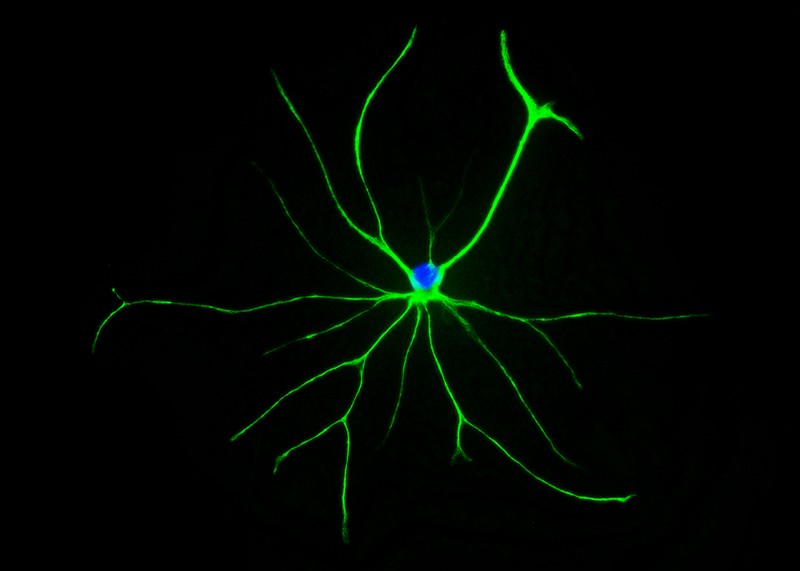 |
Astrocito: Un astrocito perteneciente a un cachorro de rata
que fue investigado usando una técnica conocida como inmunobarrido.
Imagen: Rachel Kim |
A mediados
de la década de 1850, el anatomista alemán Rudolf Virchow y colegas que examinaban
cerebros bajo el microscopio notaron estructuras misteriosas que llenaban el
espacio alrededor y entre las neuronas. Virchow llamó a estas estructuras
nervenkitt, literalmente "pegamento nervioso", y se tradujo como
"neuroglia".
Hoy en día,
los investigadores saben que los nervenkitt son en su mayoría astrocitos, que
representan del 20 al 40% de todas las células en un cerebro de mamífero. Sin
embargo, durante décadas, los roles de estas células abundantes se mantuvieron
tan misteriosos como cuando Virchow vio por primera vez estas estructuras.
A
diferencia de las neuronas, los astrocitos son eléctricamente silenciosos, por
lo que su actividad no se detecta con los métodos convencionales de
electrofisiología. También son asombrosamente complejos: un solo astrocito
puede conectarse a decenas de miles de neuronas.
Es por eso
que "no ha habido un conjunto de herramientas con las que se pudiera explorar estas células de manera selectiva y fiable
en todo el cerebro", según Baljit Khakh, neurocientífico de la Universidad
de California en Los Ángeles (UCLA).
Pero Khakh
y un número creciente de investigadores en todo el mundo están comenzando a ir
más allá del enfoque centrado en las neuronas para observar de cerca a los
astrocitos. Están desarrollando tecnologías para clasificar las células en
distintos subtipos con diversos roles y descubrir cómo los astrocitos soportan
y dan forma a los circuitos neuronales. Las herramientas podrían incluso ayudar
a los investigadores a diseñar métodos para tratar enfermedades cerebrales.
Radios de
bicicleta y copos de nieve
Cuando se
tiñen con anticuerpos y se observan bajo un microscopio, los astrocitos se
asemejan a las ruedas de una bicicleta: un gran cuerpo de células centrales con
media docena de radios gruesos, según Shane Liddelow, neurocientífico de la
Universidad de Nueva York. Pero cuando las células individuales se inyectan con
un tinte fluorescente, se hacen visibles más estructuras. Sus cuerpos centrales
se ramifican en estructuras cada vez más
finas, como un copo de nieve en 3D. Estas células en forma de copos de nieve
envuelven cada sinapsis en el cerebro, y algunos de los extremos mas finos
tienen extensiones en forma de bulbo que rodean los vasos sanguíneos, formando
una zona protectora entre el tejido cerebral y la vasculatura.
Calificados
como meras células de soporte durante más de un siglo, los astrocitos en
realidad tienen funciones cruciales en el cerebro. Los científicos están
investigando estas diversas funciones con métodos para clasificar y hacer
crecer las células, así como con herramientas de edición genética y técnicas
ópticas que rastrean cómo se comportan las células en los circuitos. Estas
tecnologías muestran que los astrocitos ajustan sus actividades metabólicas
para controlar los niveles de neurotransmisores, regulan los iones de potasio
extracelulares para influir en los umbrales de la activación de las células
nerviosas y liberan moléculas que promueven la formación y reducción de las
sinapsis. Los astrocitos son "el principal homeostato del cerebro", según
Khakh.
Para Benjamin
Deneen, las primeras pistas de esa diversidad surgieron hace una década,
mientras era postdoctorado en el Instituto de Tecnología de California
(Caltech) en Pasadena. Él y sus compañeros de trabajo estaban analizando el
tejido de la médula espinal de pollos y ratones, y encontraron que los astrocitos
exhibían patrones espaciales. Es decir, las combinaciones regionales de
proteínas reguladoras de unión al ADN llamadas factores de transcripción
determinaban cuándo y qué subtipos de astrocitos se producen.
Eso hizo
que Deneen se preguntara acerca de la heterogeneidad en el cerebro. Pero, a
diferencia de la médula espinal, donde los patrones están bien definidos, cada
área del cerebro parece estar sujeta a diferentes reglas.
Deneen
recurrió a una técnica llamada Clasificación de Células Activadas por Fluorescencia
(FACS). Utilizando la técnica en ratones que habían sido modificados
genéticamente para expresar proteínas fluorescentes verdes específicamente en
astrocitos, su equipo fue capaz de subdividir las células en cinco grupos
distintos pero superpuestos en base a su expresión de tres proteínas de la
superficie celular. Luego, los investigadores utilizaron la secuenciación de ARN
para identificar firmas moleculares para cada subpoblación.
En un
estudio separado, Khakh y sus colegas aislaron astrocitos de distintos
circuitos cerebrales en el nucleo estriado y el hipocampo de ratones de la
misma cepa. Utilizaron métodos tales como imágenes de calcio, espectrometría de
masas, inmunohistoquímica, microscopía electrónica y secuenciación de ARN para
sondear la función celular, morfología y características moleculares.
"Los
astrocitos en diferentes partes del cerebro no son lo mismo", según Khakh.
Por ejemplo, en el hipocampo, se anidan más cerca de las sinapsis neuronales
excitadoras y responden con más fuerza al neurotransmisor glutamato que en las
del estriado. "Esto sugiere que los astrocitos pueden ser específicos del
área del cerebro, o incluso del circuito neuronal”.
Por su
parte, el grupo de Deneen no solo recopiló datos moleculares de subconjuntos de
astrocitos aislados con FACS, sino que también analizó la presencia de esas
células en modelos de cáncer cerebral en ratones. El equipo identificó
poblaciones que se correlacionaban con la progresión del tumor y la aparición
de convulsiones. "Estas poblaciones podrían utilizarse como un punto de
entrada para comprender las identidades malignas
o diversas de los astrocitos y sus propiedades en la enfermedad”.
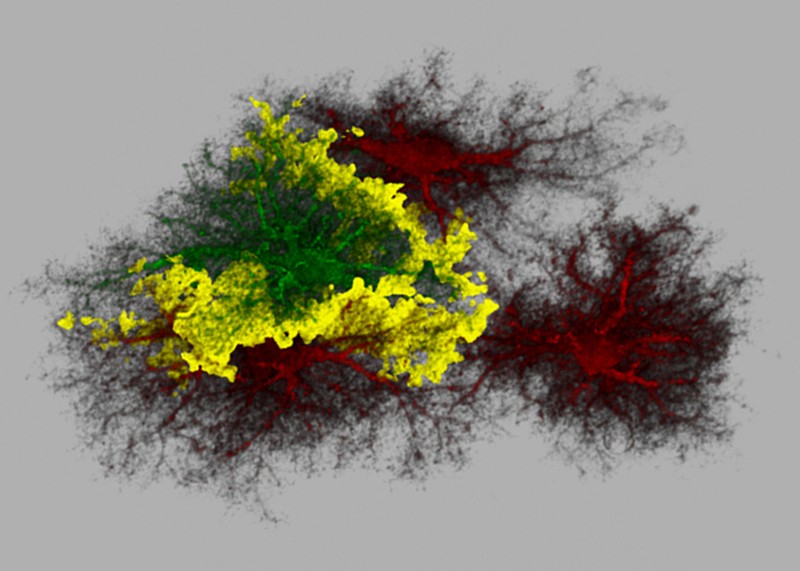 |
Los astrocitos tienen una forma de ramificación 3D distintiva.
Imagen: Centro Nacional para la Investigación de Microscopía e Imagen, UCSD |
Cultivando astrocitos
El método
más rápido y fácil de cultivar astrocitos en cultivos celulares se publicó en
1980 y ha sido un puntal de la investigación. "Esencialmente, se agita el cerebro, se espera un par de semanas,
se hace crecer las células en suero, se descartan las células de la parte
superior y las que quedan son astrocitos", dice Liddelow. El protocolo es
rápido y barato, no requiere equipo especial y produce cientos de millones de
células.
Pero hay
advertencias sobre este método del "astrocito MD", que lleva el
nombre de sus desarrolladores, Ken McCarthy en la Escuela de Medicina de la
Universidad de Carolina del Norte en Chapel Hill, y Jean de Vellis en UCLA. Una
es que cuando los astrocitos crecen en el suero, pueden comenzar a comportarse
de manera muy diferente del estado de reposo fisiológico. Además, dice
Liddelow, el método genera un buen número de células precursoras, lo que podría
ser problemático dependiendo de lo que los investigadores quieran hacer con los
cultivos celulares.
En 2011,
surgió un protocolo conocido como immuno-barrido del laboratorio de Ben Barres
en la Universidad de Stanford en California. Primero, el procedimiento elimina
las células no deseadas a través de una serie de incubaciones en placas
recubiertas con anticuerpos contra antígenos que están presentes en las
superficies de esas células, y luego se aíslan los astrocitos utilizando
anticuerpos que reconocen un marcador de proteína específico, conocido como
integrina β-5. "Obtenemos células maduras sin suero en una placa Petri y con
menos del 1% de contaminación", según Liddelow, quien utiliza la técnica
en su laboratorio.
Esta
técnica requiere aproximadamente 6 horas de tiempo práctico, en comparación con
2 a 3 horas para el protocolo MD. Pero las células así obtenidas pueden usarse
de inmediato, mientras que el método de DM requiere otras 3 a 4 semanas. Aún
así, esta técnica no siempre es la mejor opción. Su rendimiento es
aproximadamente un orden de magnitud inferior al del procedimiento MD. También
es más caro porque utiliza factores de crecimiento purificados en lugar de
suero.
Liddelow y
sus colegas han utilizado células obtenidas con la técnica de inmunobarrido para
identificar dos subpoblaciones de astrocitos. Los astrocitos A1 pierden su
capacidad para promover la formación de sinapsis, mientras que los astrocitos
A2 sobreregulan los factores neurotróficos. De acuerdo con esas
características, el equipo de Liddelow encontró una gran cantidad de astrocitos
A1 en muestras de tejido obtenidos de personas con las enfermedades de
Alzheimer, Huntington, Parkinson, Esclerosis lateral amiotrófica o Esclerosis
múltiple, lo que sugiere que los astrocitos A1 contribuyen a la muerte celular
en trastornos neurodegenerativos.
Para Henrik
Ahlenius, un líder de grupo en la Universidad de Lund en Suecia, los astrocitos
proporcionan un sustrato para estudiar el Alzheimer, la demencia frontotemporal
y otras enfermedades relacionadas con la edad. Pero su investigación requiere
astrocitos humanos, que son más grandes y tienen más sinapsis que los
astrocitos de ratón. También son más difíciles de obtener.
"Si se
desea estudiar la progresión de la enfermedad o los mecanismos en las
enfermedades cerebrales crónicas, es muy difícil obtener una muestra del
tejido", según Ahlenius. En los
raros casos en que su equipo obtiene células de biopsias o tejido post-mortem,
a menudo es difícil trabajar con las muestras porque provienen de la enfermedad
en etapa terminal.
En 2015,
investigadores en Italia mostraron cómo se podían generar astrocitos de ratón
en el laboratorio mediante el cultivo de fibroblastos con tres factores de
transcripción, un proceso llamado conversión directa. Ahlenius y sus colegas
han probado esas moléculas en células madre embrionarias humanas y encontraron
que dos de ellas, NFIB sola o con SOX9, produjeron astrocitos con una pureza de
más del 90% en solo una semana.
Estas
células se comportan como los astrocitos humanos purificados: pueden captar y
liberar glutamato; Responde a los factores de crecimiento y apoya las sinapsis
y expresa genes similares. También se pueden usar para modelar la enfermedad de
Alexander, un trastorno raro del sistema nervioso.
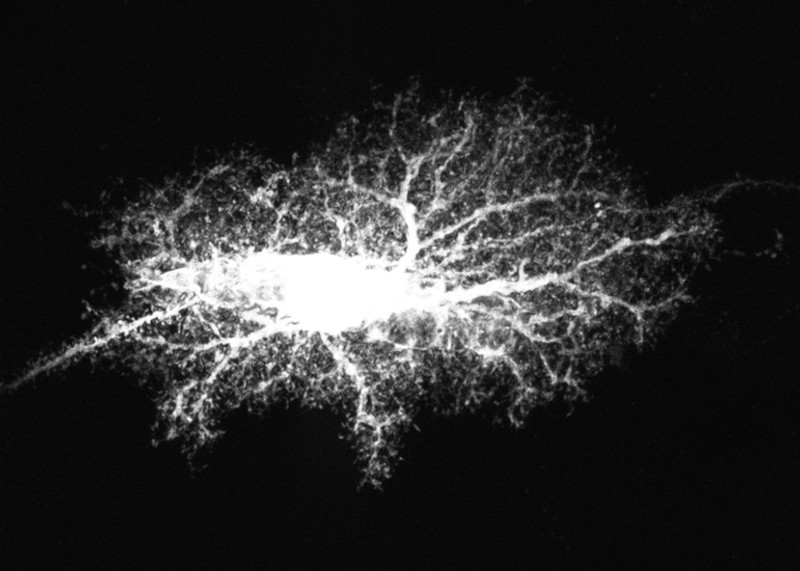 |
Un
astrocito teñido de tinte obtenido del
hipocampo de rata
adquiere una apariencia de "copo de nieve".
Imagen:
Centro Nacional para la Investigación de Microscopía e Imagen, UCSD
|
Utilizando
la manipulación genética
Para
comprender cómo se comportan los astrocitos tanto en la salud como en la
enfermedad, los investigadores necesitan herramientas con las que introducir
genes de manera fiable y específica. Con ese fin, el laboratorio de Viviana
Gradinaru en Caltech ha diseñado vectores basados en virus adenoasociados (AAV) que pueden transmitir
genes al cerebro del ratón
después de la
inyección intravenosa.
Estos vectores les permiten a los investigadores aumentar o disminuir el número
de células que se etiquetan mientras mantienen una alta expresión.
En última
instancia, los científicos quieren estudiar cómo interactúan los astrocitos con
las neuronas. A principios de este año, el equipo de Khakh describió un ensayo
de proximidad neurona-astrocito que podría determinar a cuál de las decenas de
miles de sinapsis cercanas los astrocitos se conectaban realmente.
El ensayo
utiliza una técnica llamada transferencia de energía de resonancia de Förster,
o FRET, para detectar contactos físicos entre astrocitos y neuronas que
expresan proteínas fluorescentes en su superficie. Utilizando este método y los
AAV personalizados de su laboratorio, el equipo de Khakh examinó cómo los
astrocitos se conectan con la comunicación neuronal en varias enfermedades. En
un modelo de ratón de accidente cerebrovascular, los astrocitos marcados con
estas proteínas parecían ampliar su alcance, mientras que en los animales que
modelan la enfermedad de Huntington, los astrocitos se retractaron de sus
procesos e interactuaron con menos sinapsis.
Diseño de
circuito
Kira
Poskanzer, neurocientífica de la Universidad de California en San Francisco,
estudia otro aspecto más de la biología de los astrocitos: cómo responden las
células a las señales externas. "Un gran objetivo en nuestro laboratorio
es descubrir qué astrocitos están modulando qué neurotransmisores"
Poskanzer
colabora con el químico analítico Roberto Etchenique en la Universidad de
Buenos Aires para diseñar compuestos "atrapados", en los que los
neurotransmisores se unen de manera reversible a grupos químicos que restringen
sus interacciones con otras moléculas en la célula. Los compuestos son
sensibles a la luz, y liberarán la molécula atrapada cuando se iluminen con luz
de una longitud de onda particular.
Hasta el
momento, los investigadores han generado formas fotoactivables de los
neurotransmisores glutamato, GABA y serotonina, y están desarrollando una forma
fotoactivable de noradrenalina. "Estamos tratando de construir un arsenal
de herramientas para poder" jugar a dios "con el circuito", según
Poskanzer, es decir, activar mediante fotones varios neurotransmisores y ver
cómo responden los astrocitos.
Mientras
tanto, para investigar qué sucede cuando se silencian los astrocitos, el equipo
de Khakh ha desarrollado un método que utiliza una bomba molecular para mover
los iones de calcio desde el interior de la célula hacia el exterior y, por lo
tanto, amortiguar las señales de calcio de los astrocitos en el cerebro del
ratón. Y su equipo está trabajando con Loren Looger en el Campus de
Investigación Janelia del Instituto Médico Howard Hughes en Ashburn, Virginia,
para desarrollar sensores para ATP y otras moléculas liberadas por los
astrocitos.
Estas
herramientas deberían ayudar a los investigadores a analizar separadamente la
biología de la neuroglia y la de las neuronas que forman el cerebro
interconectado. Las tecnologías están proporcionando una apreciación sin
precedentes de la riqueza y la dinámica en la forma en que los astrocitos
contribuyen a la función del cerebro como órgano.
Basado en: Nature 563, 141-143 (2018) doi: 10.1038/d41586-018-07197-0






