Si la evolución volviera a suceder aquí en la Tierra,
¿surgiría el mismo tipo de inteligencia por segunda vez? Y si lo hiciera,
¿podría aparecer en alguna otra rama del árbol animal?
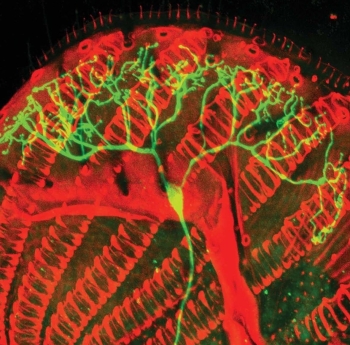
El cerebro del ctenóforo, o nuez de mar, algo parecido a
una medusa, sugiere que, si la evolución
comenzara de nuevo, la inteligencia volvería a emerger porque la naturaleza
camina siempre por la misma senda.
Leonid Moroz, neurocientífico, ha pasado dos décadas tratando de comprobar
una idea sorprendente: la existencia de animales de biología y cerebro completamente diferentes, aquí mismo
en la Tierra. Esos “aliens” se han escondido a plena vista durante milenios.
Tienen mucho que enseñarnos sobre la naturaleza de la evolución y sobre lo que podemos
esperar cuando descubramos la vida en otros mundos.
Moroz había dedicado años de investigación a estudiar los
sistemas nerviosos en todo el reino animal, con la esperanza de comprender el
origen evolutivo de los cerebros y la inteligencia.

El ctenóforo fue considerado durante mucho tiempo
simplemente otro tipo de medusa. Pero Moroz hizo un descubrimiento sorprendente:
debajo del monótono exterior de este animal, había un caso monumental de
identidad equivocada. Desde sus primeros experimentos, pudo ver que estos
animales no estaban relacionados con las medusas. De hecho, eran profundamente
diferentes de cualquier otro animal en la Tierra.
Moroz llegó a esta conclusión buscando en las células
nerviosas de los ctenóforos los
neurotransmisores serotonina, dopamina y óxido nítrico, mensajeros químicos
considerados el lenguaje neuronal universal de todos los animales, asi como los
respectivos receptores. Pero por más que lo intentaba, no podía encontrar estas
moléculas. Las implicaciones eran profundas.
El ctenóforo ya era conocido por tener un sistema
nervioso relativamente avanzado; pero estos primeros experimentos de Moroz
mostraron que sus nervios se construyeron a partir de un conjunto diferente de
bloques de construcción moleculares -diferentes de cualquier otro animal-
usando 'un lenguaje químico diferente', es decir, estos animales son 'extraterrestres del mar'.
Si Moroz tiene razón, entonces el ctenóforo representa un
experimento evolutivo de proporciones deslumbrantes, que ha estado funcionando
durante más de medio billón de años. Esta vía de evolución separada, una
especie de Evolution 2.0, ha inventado neuronas, músculos y otros tejidos
especializados, independientemente del resto del reino animal, utilizando
diferentes materiales de partida.
Este animal, el ctenóforo, proporciona pistas sobre cómo
podría haber evolucionado la evolución si no hubiera sido por el advenimiento
de vertebrados, mamíferos y humanos, que llegaron a dominar los ecosistemas de
la Tierra. Arroja luz sobre un debate profundo que se ha desatado durante
décadas: cuando se trata de analizar la vida en la Tierra, ¿cuánto de eso
sucedió por puro accidente y cuánto fue inevitable desde el principio?
El ctenóforo ofrece algunas pistas tentadoras al mostrar
cuán diferentes pueden ser los cerebros. Los cerebros son el caso más
importante de la evolución convergente: el proceso por el cual las especies no
relacionadas desarrollan rasgos similares para sobrevivir en el mismo tipo de
mundo. Los humanos podríamos haber desarrollado un intelecto sin precedentes,
pero el ctenóforo sugiere que quizás no estemos solos. La tendencia de los
sistemas nerviosos complejos a evolucionar es probablemente universal, no sólo
en la Tierra, sino también en otros mundos.
El ctenóforo es
poco conocido. Su cuerpo se parece superficialmente al de una medusa:
gelatinosa, oblonga o esférica, con una boca circular en un extremo. Los
ctenóforos son abundantes en los océanos, pero los científicos los descuidaron
durante mucho tiempo.

A diferencia de la medusa, que usa los músculos para
mover su cuerpo y nadar, el ctenóforo usa miles de cilios para nadar. Y a
diferencia de las medusas con sus tentáculos punzantes, el ctenóforo caza con
dos tentáculos pegajosos que secretan cola, una adaptación sin paralelo en el
resto del reino animal. El ctenóforo es un depredador voraz, conocido por sus
tácticas de emboscada. Caza extendiendo sus tentáculos ramificados y pegajosos
para formar algo así como una telaraña, y atrapa a su presa meticulosamente,
una por una.
Cuando los científicos comenzaron a examinar el sistema
nervioso del ctenóforo a fines del siglo XIX, lo que veían a través de sus
microscopios parecía normal. Una gruesa maraña de neuronas se encontraba cerca
del polo sur del animal, una red difusa de nervios extendidos por todo su
cuerpo, y un puñado de gruesos paquetes de nervios extendidos a cada tentáculo y
a cada una de sus ocho bandas de cilios. Los estudios del microscopio
electrónico en la década de 1960 mostraron lo que parecían ser sinapsis entre
estas neuronas, con compartimentos similares a burbujas listos para liberar
neurotransmisores que estimularían la célula vecina.
Los científicos inyectaron calcio a las neuronas de los
ctenóforos vivos, lo que les provocó el impulso de pulsos eléctricos, tal como
sucede en los nervios de ratas, gusanos, moscas, caracoles y cualquier otro
animal. Al estimular los nervios adecuados, los investigadores incluso pudieron
provocar que sus cilios giraran en diferentes patrones, haciendo que nadara
hacia delante o hacia atrás.
En resumen, los nervios del ctenóforo parecían formarse y
actuar como los de cualquier otro animal.
Entonces los biólogos supusieron que
eran lo mismo. Esta visión de los ctenóforos reproducía una narración más
amplia sobre la evolución de todos los animales, una que también resultaría
errónea.
En la década de 1990, los científicos habían colocado a
los ctenóforos en el árbol animal de la vida, en una rama al lado de los cnidarios,
el grupo que incluye medusas, anémonas de mar y coral. Las medusas y los
ctenóforos tienen músculos, y ambos tienen sistemas nerviosos difusos que no se
han condensado completamente en un cerebro. Y, por supuesto, ambos tienen
cuerpos que son famosos por ser suaves, ondulados y, a menudo, transparentes.
En el árbol evolutivo, debajo de los ctenóforos y las medusas,
había otras dos ramas de animales que eran claramente más primitivas: los placozoos
y las esponjas marinas, que carecían de células nerviosas de ningún tipo. La
esponja en particular parecía apenas estar en la cúspide de la animalidad: no
fue hasta 1866 que el biólogo inglés Henry James Clark demostró que la esponja
era, de hecho, un animal.
Esto ayudó a consagrar a la esponja como nuestro vínculo
vivo más cercano a un mundo antiguo, pre-animal de protistas unicelulares,
similar a la ameba moderna y el paramecio. Los investigadores razonaron que las
esponjas habían evolucionado cuando los antiguos protistas se reunieron en colonias,
con cada célula utilizando sus estructuras parecidas a un flagelo similar a los
cilios, para alimentarse en lugar de nadar.
Esta narración apoyaba la opinión conveniente de que el
sistema nervioso había evolucionado gradualmente, hacia una mayor complejidad,
con cada rama sucesiva del árbol animal. Todos los animales eran hijos e hijas
de un solo momento de creación evolutiva: el nacimiento de la célula nerviosa.
Y solo una vez, en la evolución posterior, esas neuronas cruzaron un segundo
umbral trascendental: se agregaron formando un cerebro centralizado. Este punto
de vista fue reforzado por otra línea de evidencia: las sorprendentes
similitudes en la forma en que las células nerviosas individuales se organizan tanto
en insectos como en humanos, en los circuitos neuronales subyacentes a la
memoria episódica, la navegación espacial y el comportamiento general. De
hecho, los científicos sostuvieron que el primer cerebro debe haber aparecido
bastante temprano, antes de que los antepasados de los insectos y los
vertebrados se separaran en diversas formas evolutivas. Si esto fuera cierto,
entonces los 550 a 650 millones de años transcurridos desde ese evento
representarían una sola trama, con múltiples linajes animales elaborados sobre
el mismo patrón cerebral básico a lo largo de la cadena.
Esta imagen de la evolución del cerebro tenía sentido,
pero Moroz comenzó a sospechar que estaba profundamente equivocada. Para
demostrar su corazonada, recolectó varias especies de ctenóforos. Cortó sus
tejidos neurales en finas láminas y los trató con reactivos químicos que
indicarían la presencia de dopamina, serotonina u óxido nítrico, tres
neurotransmisores que están diseminados por todo el reino animal. Una y otra
vez, miró al microscopio y no vio rastros de las manchas amarillas, rojas o
verdes, que deberían haber aparecido.
Una vez que repites los experimentos, obteniendo un
resultado inesperado, según Moroz: "Comienzas a darte cuenta de que es un
animal realmente diferente". Conjeturó que el ctenóforo no era solo
diferente de su supuesto grupo hermano, la medusa. También era muy diferente de
cualquier otro sistema nervioso en la Tierra.
El ctenóforo parecía haber seguido un camino evolutivo
completamente diferente, pero Moroz no podía estar seguro, por lo que trató de
aquilatar su conocimiento sobre esta especie. Así que recurrió al análisis genético de individuos de
esta especie, hasta conseguir un "transcriptoma" parcial del
ctenóforo: unas 5.000 o 6.000 secuencias de genes que están activos en las
células nerviosas del animal. Los resultados fueron sorprendentes.
Primero, mostraron que el ctenóforo carecía de los genes
y las enzimas requeridas para fabricar una larga lista de neurotransmisores
ampliamente encontrados en otros animales. Estos neurotransmisores perdidos
incluían no solo los que Moroz había notado: serotonina, dopamina y óxido
nítrico, sino también acetilcolina, noradrenalina y otros. El ctenóforo también
carecía de genes para los receptores que permiten a una neurona capturar estos
neurotransmisores y responder a ellos.
Esto confirmó lo que Moroz había esperado años para
descubrir: que cuando no conseguía encontrar neurotransmisores comunes en los
nervios de los ctenóforos, no era simplemente que sus experimentos no
funcionaban; más bien, era porque el animal no los estaba usando de ninguna
manera.
"Todos usamos neurotransmisores", según Moroz, "De
las medusas a los gusanos, a los moluscos, a los humanos, a los erizos de mar,
verás un conjunto muy consistente de moléculas de señalización." Pero, de
alguna manera, el ctenóforo había desarrollado un sistema nervioso en el que
estos roles eran ocupados por otros compuestos diferentes, un conjunto todavía desconocido
de moléculas.
El ctenóforo había evolucionado desde cero, utilizando un
conjunto diferente de moléculas y genes distinto al de cualquier otro animal
conocido en la Tierra.
Las secuencias de transcriptoma y ADN genómico que
analizó Moroz mostraron que el ctenóforo también carecía de muchos otros genes,
conocidos del resto del reino animal, que son cruciales para construir y operar
sistemas nerviosos. Al ctenóforo le faltaban muchas proteínas comunes que
forman los canales iónicos que generan señales eléctricas que viajan
rápidamente por un nervio. Le faltaban genes que guían las células embrionarias
a través de la compleja transformación en células nerviosas maduras. Y le
faltaban genes conocidos que orquestan la conexión gradual de esas neuronas en
circuitos maduros y funcionales. "Fue mucho más que solo la presencia o
ausencia de unos pocos genes", según Moroz "Fue realmente un gran
cambio de diseño".
Significaba que el sistema nervioso del ctenóforo había
evolucionado desde cero, utilizando un conjunto diferente de moléculas y genes distinto
al de ningún otro animal conocido en la Tierra. Era un caso clásico de
convergencia: el linaje de los ctenóforos había desarrollado un sistema
nervioso usando cualquier material de partida genético disponible. En cierto
sentido, era un sistema nervioso alienígena, desarrollado por separado del
resto del reino animal.
Pero las sorpresas no se detuvieron allí. El ctenóforo
estaba resultando ser único y distinto de otros animales en mucho más que solo
su sistema nervioso. Los genes involucrados en el desarrollo y la función de
sus músculos también eran completamente diferentes. Y el ctenóforo carecía de
varias clases de genes que modelaran el cuerpo en general, que se pensaba eran
universales para todos los animales. Estos incluían los llamados genes de micro
ARN, que ayudan a formar tipos celulares especializados en órganos, y genes
HOX, que dividen los cuerpos en partes separadas, ya sea el cuerpo segmentado
de un gusano o langosta, o la columna vertebral segmentada y los huesos de los
dedos de un humano. Estas clases de genes estaban presentes en las esponjas y en
los placozoos, pero ausentes en los ctenóforos.
Todo esto apuntaba a una sorprendente conclusión: a pesar
de ser más complejos que las esponjas y los placozoos -que carecen de células nerviosas
y músculos y prácticamente cualquier otro tipo de célula especializada- los
ctenóforos no formaban parte del antiguo árbol animal de la vida. De alguna
forma durante 550 a 750 millones de años, el ctenóforo había logrado
desarrollar un sistema nervioso y músculos de complejidad similar a los de
medusas, anémonas, estrellas de mar y muchos tipos de gusanos y mariscos,
improvisados a partir de un conjunto alternativo de genes.
Moroz finalmente publicó su genoma del ctenóforo
Pleurobrachia en la revista NATURE, en junio de 2014. Su trabajo, tras siete
años de investigación, estableció firmemente que las células nerviosas y el
sistema nervioso del ctenóforo se habían
desarrollado por separado de los de todos los demás animales. El ctenóforo
representaba por tanto lo más parecido a un cerebro alienígena, en la Tierra.
Los ctenóforos proporcionan un ejemplo extremo y
llamativo de lo que probablemente sea un patrón general: así como los ojos, las
alas y las aletas evolucionaron muchas veces en el curso de la evolución
animal, también así lo hicieron las células nerviosas. Moroz ahora cuenta de 9
a 12 orígenes evolutivos independientes del sistema nervioso, incluyendo al
menos uno en cnidaria (el grupo que incluye medusas y anémonas), tres en
equinodermos (el grupo que incluye estrellas de mar, lirios de mar, erizos y galletas
de mar), uno en artrópodos (el grupo que incluye insectos, arañas y
crustáceos), uno en moluscos (el grupo que incluye almejas, caracoles,
calamares y pulpos), uno en vertebrados, y ahora, al menos uno en ctenóforos.
"Hay más de una forma de hacer una neurona, más de
una forma de hacer un cerebro", dice Moroz. En cada una de estas ramas
evolutivas, se eligió ciegamente un subconjunto diferente de genes, proteínas y
moléculas, a través de la duplicación y mutación genética al azar, para
participar en la construcción de un sistema nervioso.
Lo que es fascinante es cómo estas diferentes vías de
evolución llegaron a sistemas nerviosos que se ven muy similares en todo el
árbol animal de la vida. Tomemos, por ejemplo, el trabajo de Nicholas
Strausfeld, neuroanatomista de la Universidad de Arizona en Tucson. Él y otros
han descubierto que los circuitos neuronales subyacentes al olfato, la memoria
episódica, la navegación espacial, la elección del comportamiento y la visión
en los insectos son casi idénticos a los que realizan las mismas funciones en
mamíferos, a pesar del hecho de que se aprovecharon diferentes conjuntos de
genes, aunque superpuestos, para construir cada uno.
Estas similitudes reflejan dos principios clave de la
evolución, factores que probablemente sean importantes en cualquier mundo donde
haya surgido la vida. El primero es la convergencia: estas ramas lejanas del
árbol evolutivo llegaron a diseños comunes para un sistema nervioso porque cada
uno tenía que resolver los mismos problemas fundamentales. La segunda es la
historia compartida: la idea de que todos estos sistemas nerviosos construidos
de forma diferente compartían al menos algún elemento de origen común. En
nuestro mundo, cada uno evolucionó a partir de bloques de construcción
molecular que se forjaron en los entornos físicos y químicos de la Tierra
primitiva.
De hecho, gran parte de la maquinaria básica de
señalización de todos los sistemas nerviosos podría haber evolucionado a partir
de una adaptación a vida o muerte que surgió en las primeras células de la
Tierra, hace cuatro mil millones de años. Las primeras células probablemente
habitaban ambientes acuáticos, como aguas termales o piscinas de salmuera, que
contenían una mezcla de minerales disueltos que incluían algunos, como el
calcio, que amenazaban la vida. (Se sabe que moléculas biológicas importantes
como ADN, ARN y ATP se fusionan en una materia viscosa refractaria cuando se
exponen al calcio, similar a la espuma que se forma en las bañeras). Así que
los biólogos conjeturan que la vida temprana debe haber evolucionado para mantener
los niveles más bajos de calcio en el interior de sus células. Esta maquinaria
de protección puede incluir proteínas que bombean átomos de calcio al exterior de
la célula y un sistema de alarma que se activa cuando aumentan los niveles de
calcio. La evolución más tarde aprovechó esta exquisita capacidad de respuesta
al calcio para señalizar tanto en el interior como entre las células: controlar
el latido de cilios y flagelos que los microbios usan para moverse o controlar
la contracción de las células musculares o desencadenar el disparo eléctrico de
neuronas en organismos como el nuestro. Cuando comenzaron a surgir los sistemas
nerviosos, hace aproximadamente quinientos millones de años, ya se habían
establecido muchos de los componentes básicos.
Estos principios tienen enormes implicaciones para
comprender la evolución y comprender las formas que la vida podría tener en la
Tierra o en otros mundos. Arrojan luz sobre la importancia relativa del
accidente y el destino en la configuración de la trayectoria de la evolución a
lo largo de miles de millones de años.
El fallecido paleontólogo de Harvard, Stephen Jay Gould,
argumentó en su libro Vida Maravillosa (1989) que los accidentes importan: que
la historia evolutiva de los animales ha sido determinada tanto por la
destrucción como por la innovación. Señaló que el mundo cámbrico hace 570
millones de años contenía más grupos de animales, llamados phyla, que existen
hoy en día. Esas ramas diversas en el árbol animal temprano fueron
constantemente podadas por las extinciones masivas. Esas extinciones
alimentaron la evolución al abrir nichos ecológicos en los que los grupos de
animales supervivientes podrían diversificarse, proporcionando oportunidades
para la innovación.
Al mismo tiempo, Simon Conway Morris, un paleontólogo de
la Universidad de Cambridge, ha enfatizado la importancia de la convergencia
evolutiva: que la evolución tiende a llegar a las mismas soluciones una y otra
vez, incluso en ramas distantes del árbol animal, e incluso cuando las
proteínas o genes utilizados para construir una estructura similar no están
relacionados.
Si llevamos estas dos ideas a sus fines lógicos, se llega a una conclusión sorprendente. Si la
historia de la Tierra fuese rebobinada y reproducida, la evolución podría no
llegar al presente actual con la misma variedad de grupos de animales que vemos
hoy. Mamíferos o pájaros, quizás incluso todos los vertebrados, podrían estar
ausentes. Pero la evolución aún podría llegar a la mayoría, o incluso a todas
las mismas innovaciones que permitieron la aparición de cerebros sofisticados:
esas innovaciones podrían simplemente emerger en otras ramas del árbol animal.
Mientras los científicos especulan qué tipo de vida
podría existir en otros mundos, una idea provocadora se está afianzando: esa
vida alienígena, a diferencia de todo lo que conocemos, podría existir ya aquí
en la Tierra. La idea es que la vida pudo haber surgido dos o más veces en
nuestro planeta, no solo una vez, como se suponía. Nuestra forma de vida llegó
a dominar, mientras que otras formas retrocedieron a los rincones. Esta
'biosfera en la sombra' sería difícil de detectar, ya que podría no contener
ADN, proteínas u otras moléculas de las que dependemos para detectar la vida.